发布时间:2024-12-25 浏览:122次
COPD 是由暴露于吸入颗粒物(如香烟烟雾和空气污染物)以及遗传、发育和社会因素共同引起的疾病,表现为持续性气流阻塞和呼吸道症状 [1] 。COPD是目前发展中国家和发达国家中老年人最常见的呼吸系统疾病,并且发病率和死亡率持续升高。
因此,研究COPD 的发病机制以及防治方法尤其重要。目前COPD 的发病机制尚不完全明确。近几年越来越多的研究表明,肠道与肺部之间存在病理生理的相互作用,即肠-肺轴[2] 。
随着测序技术的进步,目前认为肠-肺轴可能的机制与肠道菌群密切相关。已有研究指出,肠道菌群的主要代谢产物短链脂肪酸(short-chain fattyacid,SCFA) 是肠-脑轴内沟通肠道和大脑的重要介质[3] ,但目前关于 SCFA 在肠-肺轴中的作用尚不完全明确。
本文就近年来 SCFA 在 COPD 中的研究进展归纳总结,旨在为 COPD 的防治提供新思路。
1 肠道菌群与 COPD
1.1 肠道菌群
肠道内有密集而丰富的微生物群定植,肠道微生物群主要由肠道菌群组成,而肠道菌群包括丰度较高的厚壁菌门(如乳杆菌、肠球菌、梭状芽孢杆菌和芽孢杆菌)和拟杆菌门(如拟杆菌和普雷沃氏菌),以及丰度较低的放线菌门(如双歧杆菌)和变形菌门(如大肠杆菌)等[4] 。过去 10 年来对人类微生物群的研究表明,肠道菌群可调节胃肠道系统和远端器官的免疫反应,有助于影响和维持身体稳态,而肠道菌群失衡则会对肺部疾病产生深远影响。[5]
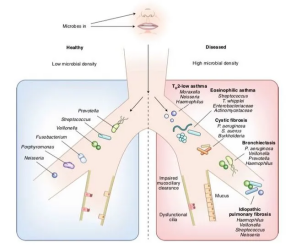
健康(左)与疾病(右)环境下的肺微生物群
1.2 肠道菌群和 COPD 的相互关系
COPD 病人的肠道菌群构成会发生变化,COPD 的进展也常常伴随着肠道菌群的改变。研究发现,与稳定期 COPD 病人和非吸烟者相比,COPD 急性加重期病人厚壁菌门和放线菌门的相对含量降低,拟杆菌门和变形菌门增加[6] 。同样的,肠道菌群的改变也会影响 COPD。有研究表明,肠道菌群失衡时 COPD 的发病率更高,且与COPD 急性加重有关[7] 。在目前的研究条件下,尚无法明确肠道菌群的变化与 COPD 的因果关系,最有可能的是二者之间相互影响。
2 SCFA
目前研究认为,肠道菌群的代谢产物 SCFA 是连接肠道和肺部之间代谢和免疫轴的主要环节。SCFA在调节免疫和抗炎中表现出多种功能,是临床和实验研究的潜在重要靶点。
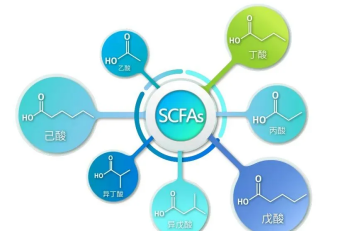
2. 1 SCFA 的来源和产生
SCFA 是指碳原子少于 6个的直链或支链脂肪酸,包括乙酸、丙酸、丁酸和戊酸等,其中,乙酸是结肠中最丰富的 SCFA。目前关于SCFA 的来源尚存在分歧,大部分研究认为 SCFA 是肠道菌群在发酵过程中产生,少数研究表明肺部微生物也可以合成 SCFA。肠道菌群发酵形成 SCFA 的底物包括膳食纤维和氨基酸;而由于底物的缺乏以及肺部SCFA 含量较低,Trompette 等[8]认为肺部微生物对形成 SCFA 没有显著贡献。
因此,目前认为 SCFA 主要来源于肠道菌群。肠道菌群将膳食纤维水解成低聚糖,COPD 是由暴露于吸入颗粒物(如香烟烟雾和空气污染物)以及遗传、发育和社会因素共同引起的疾病,表现为持续性气流阻塞和呼吸道症状 [1] 。COPD是目前发展中国家和发达国家中老年人最常见的呼吸系统疾病,并且发病率和死亡率持续升高。
2. 2 SCFA 的运输和代谢
多达 90% ~95%的 SCFA通过肠黏膜上皮细胞吸收,仅有少量 SCFA 经由粪便排泄[11] 。部分 SCFA 通过被动扩散直接进入细胞,另一部分 SCFA 需要转运蛋白的帮助[12] ,这些转运蛋白的表达可能受到肠道菌群丰度、SCFA 浓度和炎症水平的影响,进而影响 SCFA 的摄取[13] 。SCFA 被结肠上皮细胞吸收后通过三羧酸循环途径成为肠上皮细胞的主要能量来源[14] ,剩余的 SCFA 沿门静脉运输到其他功能器官,成为糖、脂质和胆固醇合成的底物。
2. 3 SCFA 的作用机制
SCFA 通过改善肠黏膜屏障功能、与免疫系统相互作用而发挥调节免疫及抗炎的作用。SCFA 的基本作用是降低肠道 pH 值,促进粘蛋白合成,从而防止有害细菌的黏附,增强上皮完整性,增强宿主全身免疫力。SCFA 可以通过抑制组蛋白去乙酰化酶来增加调节性 T 细胞、辅助性 T 细胞(Thelper cell,Th)17、Th1、Th2 细胞的数量和功能,从而抑制呼吸道疾病过度的炎症和免疫反应 [15] 。已有研究证明,SCFA 可以与不同受体相互作用,如激活 G 蛋白偶联受体参与跨膜受体的信号传导 [16] ,但这些受体在细胞内的进一步作用机制仍需更多的研究来阐明。
3 SCFA 对 COPD 的影响
与慢性阻塞性肺病全球倡议组织(GOLD) 1~2 级COPD 病人和健康志愿者相比,GOLD 3 ~ 4 级 COPD病人的 SCFA 总体水平较低[17] 。与此一致的是另一项研究报道,与健康志愿者相比,病情稳定的 GOLD 2级 COPD 病人呼出气冷凝物中 SCFA 的含量更高[18] 。研究发现,患有消化系统疾病的病人 SCFA 水平较低,更有可能发展为肺部疾病[19] 。这些研究都说明了SCFA 对 COPD 的发生和发展具有保护作用,其中可能的机制如下。
3. 1 修复气道上皮屏障功能
COPD 的特征是支气管上皮屏障功能受损,导致进行性气流受限。通过对人类支气管上皮细胞完整性的研究,结果显示 SCFA可以修复支气管上皮的屏障功能[20] 。这一发现强调了 SCFA 在调控 COPD 等疾病的屏障功能方面具有潜在的临床应用,但相关研究较少。
3. 2 延缓肺气肿的发展
肺气肿是 COPD 的病理特征之一,研究发现导致肺气肿的关键事件是肺泡间隔无血管形成,这与内皮细胞和肺泡上皮细胞的凋亡有关[21] 。SCFA 中的丁酸可以抑制内皮细胞内 NLRP3炎症小体的活化[22] ,还可增强肺微血管内皮细胞紧密连接蛋白的表达,影响内皮屏障功能[23] 。此外,乙酸和丁酸可以通过增加一氧化氮的生物利用度来改善血管紧张素转换酶诱导的内皮功能障碍 [24] 。Jang 等[25]的研究也发现,SCFA 可减弱与肺气肿进展相关的病理变化。因此,肠道菌群产生 SCFA 可能是预防肺气肿的一种机制。
3. 3 预防呼吸道感染
感染是导致 COPD 急性加重的最常见原因,SCFA 可以预防呼吸道感染。Haak等[26] 发现,当粪便中存在能大量产生 SCFA 的细菌时,接受异基因造血干细胞移植的病人发生病毒性下呼吸道感染的概率较低。SCFA 还能预防小鼠感染呼吸道合胞病毒,降低肺病毒载量和炎症[27] 。
总之,目前的研究认为,SCFA 可以预防呼吸道感染,从而减少COPD 急性加重可能。SCFA 还可以从血液到达骨髓,刺激骨髓造血干细胞成熟为单核细胞、树突状细胞等,炎症刺激下这些细胞可以从骨髓迁移到肺发挥抗炎作用 [19] 。值得一提的是,有研究表明 SCFA 不仅具有抗炎作用,还可以产生促炎作用,这取决于研究的细胞类型和 SCFA 浓度[28] 。因此,确定维持正常免疫系统和代谢所需的 SCFA 浓度至关重要。SCFA 在免疫防御中表现出多种可能,使其成为实验和临床研究的潜在重要靶点。
4 SCFA 防治 COPD 的探讨
结合 SCFA 在 COPD 中的作用,SCFA 在预防和治疗 COPD 上有强有力的潜在应用。目前尚无直接补充SCFA 制剂治疗 COPD 病人的相关研究。
4. 1 体质量
COPD 病程长,能量需求增加会导致肌肉和脂肪组织流失,因此,BMI 是评估 COPD 预后的重要标志之一[29] 。研究发现,COPD 病人体质量越低,预后不良的风险越高 [30] 。Schwiertz 等[31] 发现超重和肥胖人群总肠道细菌结构中拟杆菌门的浓度高于瘦者,同时,超重者能从大肠吸收更多的 SCFA。鉴于SCFA 在 COPD 中的保护作用,临床医师应重视 BMI对预后的指导作用。

4. 2 饮食
合理饮食是延缓 COPD 进展的重要工具。研究表明,大量摄入甜食、油、脂肪和咖啡与肺功能呈负相关,并且与男性 COPD 患病率增加有关。[32] 相比之下,食用蔬菜、水果、全麦谷物和鱼则有助于预防成人肺功能进一步恶化 [33] ,尤其是男性吸烟者和 COPD病人。此外,已有研究证明,男性 COPD 发病率的降低与较高的水果和蔬菜摄入量有关 [34] ,但是,女性患COPD 的风险降低仅与长期食用水果有关 [35] 。不过值得注意的是,这些研究没有考虑到单个食物成分和微量营养素的作用。饮食可以通过影响肠道微生物的构成改变 SCFA 的产生,进而影响免疫调节,未来的研究重点可能在饮食、肠道微生物、SCFA 和 COPD 之间的关系上。
基于肠道菌群在产生 SCFA 中的重要作用,增加膳食纤维可以改变肠道菌群的组成,进而促进 SCFA的产生,因此膳食纤维也是研究的重要方面。一项对35339 名瑞典妇女的前瞻性队列研究评估了基线和长期膳食纤维摄入量与 COPD 风险之间的关联,这项研究表明,摄入高膳食纤维可以降低当前和既往吸烟者发生 COPD 的风险,是一个重要的可改变因素 [36] 。
4. 3 益生菌
益生菌是活微生物,足量的益生菌会给宿主带来益处。最常用的益生菌是乳酸菌和双歧杆菌[37] 。益生菌能通过增加 SCFA 来提高调节性 T 细胞的数量及功能,从而抑制肺部炎症反应 。[38] 最近的研究强调了益生菌产生的 SCFAS 的免疫调节作用,但其作用机制仍需进一步研究。通过益生菌预防和治疗肠道菌群失衡,从而增加 SCFA 的含量,可能是进一步研究的重要方向。
4. 4 粪便菌群移植
粪便菌群移植可以直接改变受体肠道菌群,使其成分正常化,从而达到治疗效果,目前在胃肠道疾病及胃肠外疾病中已有广泛应用 [39-40] 。研究显示,在香烟烟雾暴露的 COPD 小鼠研究模型中,移植粪便菌群后肺气肿的严重程度明显改善 [41] ,这为COPD 的治疗思路提供了新方向。但目前粪便菌群移植在 COPD 中的相关研究较少,因此,这种方法对COPD 病人是否有效还有待进一步的验证。
5 总结与展望
目前 COPD 的发病机制仍未完全明确,但越来越多的研究证明,肠道菌群通过发酵膳食纤维可以产生SCFA,进而调节 COPD 病人肺部的免疫和炎症反应。
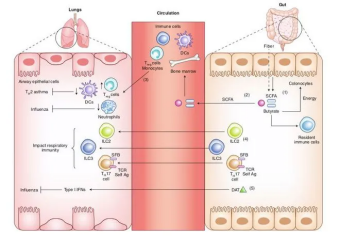
肠-肺轴内的主要通讯途径
骨髓来源的细胞在远端身体部位(如肺部)参与形成免疫反应
目前认为 SCFA 发挥作用的具体分子机制主要与抑制组蛋白去乙酰化酶和激活 G 蛋白偶联受体参与信号传导相关,但仍需要进一步研究。SCFA 可以通过修复气道上皮功能、延缓肺气肿进展、预防呼吸道感染,从而对 COPD 产生保护作用。肠道菌群的构成成分和饮食类型都会影响 SCFA 的产生,从这方面来说,通过改变饮食结构来增加膳食纤维,进而调节 SCFA 水平可能代表了一种潜在的治疗策略,也许能够影响COPD 病人的进展和预后。
值得一提的是,除了 COPD,已有研究发现肠道菌群及其代谢物 SCFA 和许多其他肺部疾病相关,包括肺癌、哮喘、肺结核、新型冠状病毒感染等 [42-43] 。鉴于呼吸系统疾病的高发病率和死亡率,进一步研究肠道菌群及 SCFA 的作用机制显得尤为重要,这可能有助于探索更有效的治疗手段。
#参考文献#
[1] CHRISTENSON S A,SMITH B M,BAFADHEL M,et al.Chronic obstructive pulmonary disease[J]. Lancet,2022,399(10342):2227-2242.
[2] ZHANG D,LI S,WANG N,et al. The cross-talk between gut microbiota and lungs in common lung diseases[J]. Front Microbiol,2020,11:301.
[3] SILVA Y P,BERNARDI A,FROZZA R L. The role of short-chain fatty acids from gut microbiota in gut-brain com-munication[J].Front Endocrinol:Lausanne,2020,11:25.
[4] ANANYA F N,AHAMMED M R,FAHEM M M,et al. As-sociation of intestinal microbial dysbiosis with chronic ob-structive pulmonary disease [J]. Cureus, 2021, 13(11):e19343.
[5] BANDER Z A L,NITERT M D,MOUSA A,et al. The gutmicrobiota and inflammation: an overview[J]. Int J EnvironRes Public Health,2020,17(20):7618.
[6] WU Y,LUO Z,LIU C. Variations in fecal microbial profiles of acute exacerbations and stable chronic obstructive pulmo-nary disease[J]. Life Sci,2021,265:118738.
[7] RAFTERY A L,TSANTIKOS E,HARRIS N L,et al. Links between inflammatory bowel disease and chronic obstructive pulmonary disease[J]. Front Immunol,2020,11:2144.
[8] TROMPETTE A,GOLLWITZER E S,YADAVA K,et al.Gut microbiota metabolism of dietary fiber influences allergicairway disease and hematopoiesis[J]. Nat Med,2014,20(2):159-166.
[9] RAMOS-GARCIA V, TEN-DOMÉNECH I, MORENO-GIMÉNEZ A,et al. GC-MS analysis of short chain fatty acids and branched chain amino acids in urine and faeces samples from newborns and lactating mothers[J]. Clin Chim Acta,2022,532:172-180.
[10] FENG W,AO H,PENG C. Gut microbiota,short-chain fatty acids,and herbal medicines[J]. Front Pharmacol,
2018,9:1354.
[11] MACIEJ ZIE , TEK,ZBIGNIEW CELEWICZ,MAłGORZATA SZCZUKO. Short-chain fatty acids,maternal microbiota and metabolism in pregnancy[J]. Nutrients,2021,13(4):1244.
[12] SALVI P S,COWLES R A. Butyrate and the intestinal epi-thelium: modulation of proliferation and inflammation in ho-meostasis and disease[J]. Cells,2021,10(7):1775.
[13] FERRER-PICÓN E,DOTTI I,CORRALIZA A M,et al.Intestinal inflammation modulates the epithelial response to butyrate in patients with inflammatory bowel disease[J]. In-flamm Bowel Dis,2020,26(1): 43-55.
[14] RAUF A,KHALIL A A,RAHMAN U UR,et al. Recent advances in the therapeutic application of short-chain fatty acids (SCFAs): an updated review[J]. Crit Rev Food SciNutr,2022,62(22):6034-6054.
[15] LI M,VAN ESCH B C A M,WAGENAAR G T M,et al.Pro-and anti-inflammatory effects of short chain fatty acids on immune and endothelial cells[J]. Eur J Pharmacol,2018,831:52-59.
[16] STURM E M,KNUPLEZ E,MARSCHE G. Role of short chain fatty acids and apolipoproteins in the regulation of eosinophilia-associated diseases[J]. Int J Mol Sci,2021,22(9):4377.
[17] LI N,DAI Z,WANG Z,et al. Gut microbiota dysbiosis contributes to the development of chronic obstructive pulmo-nary disease[J]. Respir Res,2021,22(1):274.
[18] KARAVAEVA T M,MAKSIMENYA M V,TERESHKOV PP,et al. Long-chain fatty acids and short-chain fatty acids inexhaled breath condensate of patients with chronic obstructive pulmonary disease[J]. Biomeditsinskaya Khimiya,2021,67(2):169-174.
[19] DANG A T,MARSLAND B J. Microbes,metabolites,and the gut – lung axis[J]. Mucosal Immunol,2019,12(4):843-850.
[20] RICHARDS L B,LI M,FOLKERTS G,et al. Butyrate and propionate restore the cytokine and house dust mite compro-mised barrier function of human bronchial airway epithelial cells[J]. Int J Mol Sci,2021,22(1):65.
[21] HISATA S, RACANELLI A C, KERMANI P, et al.Reversal of emphysema by restoration of pulmonary endothelial cells[J]. J Exp Med, 2021, 218(8):e20200938.
[22] YUAN X,WANG L,BHAT O M,et al. Differential effects of short chain fatty acids on endothelial Nlrp3 inflammasome activation and neointima formation: antioxidant action of bu-tyrate[J]. Redox Biol,2018,16:21-31.
[23] KAROOR V,STRASSHEIM D,SULLIVAN T,et al. The short-chain fatty acid butyrate attenuates pulmonary vascular remodeling and inflammation in hypoxia-induced pulmonaryhypertension[J]. Int J Mol Sci,2021,22(18): 9916.
[24] ROBLES-VERA I,TORAL M,DE LA VISITACIÓN N,etal. Protective effects of short-chain fatty acids on endothelial dysfunction induced by angiotensin II[J]. Front Physiol,2020,11:277.
[25] JANG Y O,KIM O H,KIM S J,et al. High-fiber diets at-tenuate emphysema development via modulation of gut micro-biota and metabolism[J]. Sci Rep,2021,11(1):7008.
[26] HAAK B W,LITTMANN E R,CHAUBARD J L,et al. Im-pact of gut colonization with butyrate-producing microbiota on respiratory viral infection following allo-HCT[J]. Blood,2018,131(26):2978-2986.
[27] ANTUNES K H,FACHI J L,DE PAULA R,et al. Microbi-ota-derived acetate protects against respiratory syncytial virus infection through a GPR43-type 1 interferon response[J].Nat Commun,2019,10(1):3273.
[28] RUTTING S,XENAKI D,MALOUF M,et al. Short-chain fatty acids increase TNFα-induced inflammation in primary human lung mesenchymal cells through the activation of p38 mapk[J]. Am J Physiol Lung Cell Mol Physiol,2019,316 (1):L157-L174.
[29] KIM E K,SINGH D,PARK J H,et al. Impact of body mass index change on the prognosis of chronic obstructive pulmonary disease [J]. Respiration, 2021, 99 ( 11 ):943-953.
[30] PUTCHA N,ANZUETO A R,CALVERLEY P M A,et al.Mortality and exacerbation risk by body mass index in patients with COPD in TIOSPIR and UPLIFT[J]. Ann Am Thorac Soc,2022,19(2):204-213.
[31] SCHWIERTZ A,TARAS D,SCHÄFER K,et al. Microbiota and SCFA in lean and overweight healthy subjects[J]. Obe-sity,2010,18(1):190-195.
[32] SHIN M K,KWAK S H,PARK Y,et al. Association between dietary patterns and chronic obstructive pulmonary disease in Korean adults: the Korean genome and epidemiology study[J]. Nutrients,2021,13(12): 4348.
[33] BALDRICK F R,ELBORN J S,WOODSIDE J V,et al.Effect of fruit and vegetable intake on oxidative stress and in-flammation in COPD: a randomised controlled trial[J]. EurRespir J,2012,39(6):1377-1384.
[34] KALUZA J,LARSSON S C,ORSINI N,et al. Fruit and vegetable consumption and risk of COPD: a prospective cohort study of men[J]. Thorax,2017,72(6):500-509.
#酒局守护神 #酉神1号 #酉神一号 #酉神壹号 #酒神1号 #酒神一号 #酒神壹号 #酉神1号解酒液 #酉神1号有机酸解酒液






