发布时间:2024-12-27 浏览:145次
在当今社会,人们越来越关注健康问题,随着科学研究的深入,短链脂肪酸引起了广泛的关注。
短链脂肪酸概论
脂肪酸是由碳、氢、氧三种元素组成的一类化合物,是中性脂肪、磷脂和糖脂的主要成分。脂肪酸是机体主要能量来源之一,在有充足氧供给的情况下,可氧化分解为CO2和H2O,释放大量能量。
小科普
脂肪酸分类
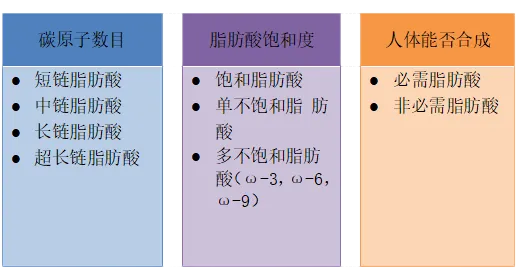
脂肪酸根据碳链长度的不同又可将其分为:
l 短链脂肪酸:
(Short chain fatty acids, SCFA)
碳链上的碳原子数小于6,也称作挥发性脂肪酸(Volatile fatty acids, VFA);
l 中链脂肪酸:
(Medium chain fatty acids,MCFA)
指碳链上碳原子数为6-12的脂肪酸,主要成分是辛酸和癸酸;
l 长链脂肪酸:
(Long chain fatty acids,LCFA)
其碳链上碳原子数大于12。
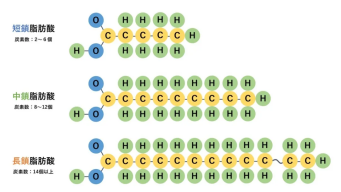
一般食物所含的脂肪酸大多是长链脂肪酸,短链脂肪酸仅在乳脂、粗粮和蔬菜中存在少量。
和中、长链脂肪酸不同,短链脂肪酸(SCFA)直到近些年随着肠道菌群的研究深入才受到关注。
研究发现人体SCFA主要来自结肠内乳酸菌、双歧杆菌等有益菌群利用膳食纤维、抗性淀粉、低聚糖等不易消化的碳水化合物酵解产生。
随着深入研究,人们发现肠道内微生物产生的短链脂肪酸对于机体有重要作用,在部分疾病的发生与发展中也扮有重要角色。短链脂肪酸与机体的关系成为目前研究的热点之一。

小科普
短链脂肪酸主要包括甲酸、乙酸、丙酸、丁酸、戊酸和己酸等。人体内的短链脂肪酸以乙酸、丙酸、丁酸三者为主,结肠内三者占比大约为60:20:20。
目前,短链脂肪酸的吸收机制尚不明确,但短链脂肪酸在体内的吸收代谢位置已经基本明确,其在动物体内能影响阳离子的吸收,同时也使自身被动物机体利用。
短链脂防酸在不同的位置被吸收然后被机体利用,主要通过以下三种方式:
01
盲肠和结肠上皮细胞利用丁酸提供能量;
02
肌肉细胞利用少量的乙酸供能;
03
肝细胞利用丙酸和丁酸合成糖类物质,50%~70%的乙酸被肝脏吸收利用。
短链脂肪酸的吸收主要是在盲肠和结肠。Fileming等研究表明,尽管近端结肠是SCFA产生的主要位置,但其动力学机制尚不清晰,通过观测SCFA的浓度及其动力学的饱和程度表明其在人体直肠中是通过被动转运吸收的,但不能代表乙酸、丙酸和丁酸这三种之间是共同促进还是竞争机制,不过,观测到在腔内乙酸的比例总是大大超过了丁酸。
短链脂肪酸的修复粘膜作用
18世纪,法国自然科学家Reaumur发现胃液能引起人体的其他体腔产生炎症坏死,却唯独胃液不能消化自身。紧接着1855年法国实验生理学家Bernard提出胃像瓷器一样耐腐蚀,直至1963年,Shay和Sun提出攻击-防御因子的平衡是维护胃健康的基础。这才慢慢的引出了胃肠粘膜屏障的理论。
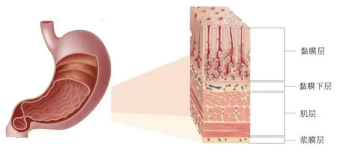
完整的胃肠粘膜屏障是正常健康的先决条件,胃黏膜屏障是胃黏膜表面存在的黏液,全称碳酸氢盐屏障,由胃黏膜表面黏液不断分泌的不可溶性黏液凝胶构成。
肠屏障是指肠道能够防止肠内的有害物质如细菌和毒素穿过肠粘膜进入人体内其他组织、器官和血液循环的结构和功能的总和。
而现在人体的胃肠粘膜因受致病菌感染侵袭、药物、饮食、胃肠运动异常等因素影响,胃肠粘膜受损是高频率发生事件,受损后带来的胃肠黏膜缺血、炎性反应、胃肠上皮细胞萎缩、坏死等,都将直接导致肠内细菌及毒素易位、全身炎症反应综合征、多器官功能衰竭、胃炎、胃溃疡、胃癌的发生。
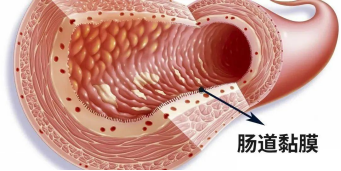
而短链脂肪酸是结肠的首选能源底物,也是结肠细胞增殖的信号,提供结肠黏膜总需能量的70%,它可以降低肠道内pH值、维护肠道上皮细胞的完整性、减少促炎因子生成、促进粘膜细胞增殖、减轻肠粘膜萎缩、维护肠粘膜形态。
大量研究表明短链脂肪酸对胃肠粘膜屏障的修护机理在于通过增加上皮电阻和紧密连接蛋白产量来加强粘膜屏障功能,避免或减轻病理反应。
短链脂肪酸在肠道中的存在直接影响胃肠粘膜屏障的通透性,从而降低肠渗透性影响细菌移位。
短链脂肪酸的抗炎作用
自1980年澳大利亚的Roediger博士根据实验结果提出,溃疡性结肠炎(UC)是由于结肠上皮SCFA利用障碍而导致的一种上皮“饥饿性病变”,自此展开了关于溃疡性结肠炎与结肠上皮短链脂肪酸利用障碍之间的研究,也由此拉开了人们对短链脂肪酸与肠炎之间的研究序幕。
1989年,Haring等首先成功地用短链脂肪酸灌肠疗法治疗转流性结肠炎,用短链脂肪酸每日灌肠两次,治疗5例转流性结肠炎病人,历时2~6周。Clausen等发现,与28例非袋囊炎患者相比,6例袋囊炎患者大便中SCFA浓度明显降低。
炎症反应是临床上一个常见的病理过程,其产生的实质实际上是机体与致炎因子进行抗争的过程。
短链脂肪酸在结肠内可被结肠上皮细胞直接吸收,为结肠黏膜提供能量,维护黏膜免疫细胞、肠道上皮细胞的完整性和杯状细胞的分泌功能,同时它还可以降低结肠内pH值,减少结肠内有害菌的生长,减少促炎因子的生成,对肠道的作用包括促进回、结肠的运动,增加肠粘膜血流及氧的摄入,增加水电解质的吸收,防止上皮细胞和腺体萎缩,促进手术后组织修复,防止渗漏等。
近年来的研究表明,应用短链脂肪酸可以增加肠吻合强度,缓解和治疗旷置性结肠炎、短肠综合症、溃疡性结肠炎、直肠切除术后的储袋炎、转流性结肠炎、袋囊炎、放射性结肠炎的临床症状、内镜和组织学表现。
短链脂肪酸调节炎症与其作用于白细胞、内皮细胞的2种途径有关,即GPCRs激活途径和组蛋白脱乙酰基酶(HDAC)抑制途径。
此外,短链脂肪酸还可以通过调节细胞因子(TNF-α、IL-2、IL-6、IL-10)以及类花生酸类(MCP-1、CINC-2)的水平、调控白细胞迁移及杀灭病原体等的过程中来发挥调节炎症的作用。
短链脂肪酸的抗肿瘤作用
早在上世纪90年代就有研究者对SCFA应用效果及机理展开了研究,近年来越来越多的研究结果表明SCFA在结肠癌、肝癌、膀胱癌、胶质癌等诸多肿瘤的体外实验中,显示了多方位的抗肿瘤效能和广泛的应用前景。
SCFA抑制肿瘤增殖的机理在于使肿瘤细胞膜上变异的G蛋白失活后抑制肿瘤细胞生长、上调组蛋白乙酰化来提高激酶抑制剂P21基因表达(阻滞细胞增殖)、与核转录因子作用后调节特异性基因表达、促使DNA甲基化和组氨酸乙酰化来影响DNA的复制和转录、通过去乙酰化酶(HDACs)拮抗作用上调乙酰化水平(使染色质处于开放状态,便于DNA基因转录与表达)。
经实验证明,乙酸、丙酸、丁酸、戊酸均有类似作用机制,其中丁酸效果最为明显。
经多项实验证明,短链脂肪酸能通过诱导肿瘤细胞分化来达到肿瘤细胞减缓、终止增殖的目的,但目前短链脂肪酸诱导肿瘤细胞分化的确切作用机制尚不明确。有观点认为诱导作用是通过上调细胞表面VD受体来实现的,也有观点认为诱导作用与丝裂原蛋白激酶(MAPK)中细胞外信号调节激酶磷酸化程度减轻有关。
此外,短链脂肪酸还有诱导细胞凋亡、影响原癌基因表达、肿瘤防治的作用。
短链脂肪酸与基础代谢的关系
众所周知,三羧酸循环是需氧生物体内普遍存在的代谢途径,分布在线粒体,是三大营养素糖类、脂类、氨基酸最终的代谢通路,对生物体具有重要的生理意义。
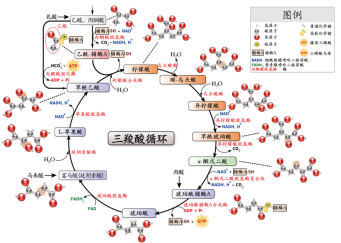
醖酵素中富含的柠檬酸、琥珀酸、苹果酸、丙酮酸、戊酸等多种短链脂肪酸是三羧酸循环中的过程物质,直接参与并加速三羧酸循环的运转,从而提高机体的代谢能力,保持健康、青春活力。
研究表明,目前已发现的仅有的2种特异性短链脂肪酸受体是GPR41和GPR43,这2种受体不仅可以通过参与调节食欲和胃肠肽的分泌来调节脂肪的分解与形成,最终与代谢性疾病如肥胖、2型糖尿病和心血管病的密切相关;而且还可以参与调节人身体血脂浓度和炎症发生过程,甚至与细胞的癌变密切相关。这2种受体作为糖代谢、脂肪代谢的重要调节受体,已经成为一个重要的药物筛选靶点。醖酵素中富含的乙酸、丙酸、丁酸、戊酸等多种短链脂肪酸能激活GPR41和GPR43受体,从而调节人体基础代谢。
值得一提的是,丙酮酸是体内产生的三碳酮酸,它是糖酵解途径的最终产物,在细胞浆中还原成乳酸供能,或进入线粒体内氧化生成乙酰CoA,进入三羧酸循环后,被氧化成二氧化碳和水,完成葡萄糖的有氧氧化供能过程,从而降低血液中的葡萄糖浓度。而丙酮酸变为乙酰辅酶A的这一过程需要丙酮酸脱氢酶的直接参与,短链脂肪酸在促进PDHc(丙酮酸脱氢酶复合体)的产生过程中扮演了重要作用。
短链脂肪酸的其他效用
从众多的文献报道中我们知道,SCFA的三大核心功效在于提供细胞能量、充当营养因子的角色,保护肠道粘膜、增强胃、肠运动机能而防止便秘。当然,SCFA的功效还远不止这些,它还可以维持水电解质平衡、调节肠道有益菌群平衡、调节免疫、调控基因表达等作用。
参考文献:
1.Hansen, et al., 2012; Hou, Abraham, & ElSerag, 2011; Schatzkin, et al, 2007; Thorburn, Macia, & Mackay, 2014.
2.万晓,王新颖,李宁。《短链脂肪酸的研究进展》[J]。中华胃肠外科杂志,2015年9月第18卷第9期。Chin J Gastrointest Surg,September 2015,Vol 18,No.9。
3.詹彦,支兴刚。《短链脂肪酸的再认识》[J]。实用临床医学,2007年第8卷第1期。Practical Clinical Medicine,2007,Vol 8,No.1。
4.CS Byrne, et al., The role of short chain fatty acids in appetite regulation and energy homeostasis. International Journal of Obesity, 39:1331–1338, 2015.
5.Sathish Sivaprakasam, et al., Benefits of Short-chain fatty acids and their receptors in inflammation and carcinogenesis, [J]. Pharmacol Ther, 164: 144–151, 2016 Augus.
6.Roberfroid, MB, ed. Inulin-Type Fructans: Functional Food Ingredients [J], Boca Raton: CRC Press; 2005.
7.任傲,童勤,张彬。短链脂肪酸的生成及其吸收机制[J],广东饲料,24(10):28-29,2015。
8.MeNeil NI, Cummings JH, James WP. Short chain fatty acid absorption by the human large intestine [J], Gut, 19:819-822.1500~1507, 1978.
9.Ruppin H, Bar-Meir s, Soergel KH, et al., Absorption of shortchain fatty acids by the colon [J], Gastroenterology, 78(6):1500-7, 1980.
10.Roediger WE, Moore A. Effect of short-chain fatty acid on sodium absorption in isolated human colon erfused through the vascular bed [J], Dig Dis Sci, 26:100~106, 1981.
11.Fleming S.E, Chol S.Y, Fitch M.D. Absorption of short-chain fatty acids from the rat cecum in vivo [J], The Journal of Nutrition, (121): 1787~1797, 1991.
12.Sathish Sivaprakasam,et al., Benefits of Short-chain fatty acids and their receptors in inflammation and carcinogenesis[J].Pharmacol Ther, 164: 144–151, 2016 August.
13.Brian F. Hinnebusch, et al., The Effects of Short-Chain Fatty Acids on Human Colon Cancer Cell Phenotype Are Associated with Histone Hyperacetylation. Nutrition and Cancer.
14.刘小华,李舒梅,熊跃玲。 《短链脂肪酸对肠道功效及其机制的研究进展》[J]。肠外与肠内营养,2012年1月第19卷第1期Parenteral & Enteral Nutrition,Vol.19,No.1,January,2012。
15.森下 芳行,小西 良子,田中 隆一郎,務台 方彦。 ラット·マウスにおける轉移オリゴ糖の腸內フローラと盲腸內短鎖脂肪酸生成に及ぼす影響[R]。ビフィズス,6:11-17,1992。
16.侯龙龙。 《肠粘膜屏障及短链脂肪酸对其影响的研究进展》。临床小儿外科杂志,8(14):331-333,2015。
17.杨定周。 《胃肠粘膜屏障损伤与高原多器官功能障碍综合征》。西南国防医学,18(2):295-298,2008。
18.Obata Y, et al., Epithelial cellintrinsic Notch signaling plays an essential role in the maintenance of gut immune homeostasis [J]. The Journal of Immunology, 188(5): 2427-2436,2012.
19.馬場 忠雄,et al., ヒストンアセチル化と転写因子活性化を介した短鎖脂肪酸による腸上皮細胞機能の制御[R]。平成12年度~平成14年度科学研究費補助金。
20.陈燕,曹郁生,刘晓华。 短链脂肪酸与肠道菌群。江西科学,2(24),2006。
21.FINK M P. Intestinal epithelial hyperpermeability: update on the pathogesis of gut mucosal barrier dysfunction in critical illness [J]. Curr Opin Care,9:143-151, 2003.
22.Roediger WEW. Lancet, 2:712-715, 1980.
23.李国法,郑红斌。 短链脂肪酸对结肠病变及作用机制的影响[J]。世界华人消化杂志,18(32):3425-3427,2010。
24.Mortensen RV,et al. Br J Surg, 78:1208~1211, 1991.
25.Clausen MR et al., Gastroenterology, 103:1143-1153, 1992.
26.许勤。短链脂肪酸的代谢及其在肠道外科中的应用。肠外与肠内营养,10(6),1999。
27.Hirofumi I, Ryuzaburo S, Susumus S,et al. Gastric or rectal instillation of short-chain fatty acids stimulates epithelial cell proliferation of small and large intestine in rats [J]. Digestive Diseases and Sciences, 47(5): 1141-1146, 2002.
28.台卫平,罗和生。 短链脂肪酸在溃疡性结肠炎病因及治疗中的作用[J]。世界华人消化杂志,B(I):96-97,1月,2000。
29.川本 勝,他。 潰瘍性大腸炎症例の便中細菌と短鎖脂肪酸。日本消化器并学会雜誌。第79卷,第2号。
30.Lin J, Nafday SM,Chauvin SN,et al. Variable effects of short chain fatty acids and lactic acid in inducing intestinal mucosal injury in newborn rats [J]. Pediatr Gastroenterol Nutr,35(4): 545-550, 2002.
31.Sathish Sivaprakasam, et al., Benefits of Short-chain fatty acids and their receptors in inflammation and carcinogenesis [J]. Pharmacol Ther,164: 144–151, August, 2016.
32.Vinolo M A,Rodrigues H G,Nachbar R T,et al. Regulation of inflammation by short chain fatty acids[J]..Nutrients,3(10):858-876,2011.
33.Levison ME. Effect of colon flora and short chain fatty acids on the growth in vitro of pseudomonas aeruginosa and Enterobacoeriaceae. Infec Immun,8:30,1973.
34.Cox M A, Jackson J, Stanton M, et al., Short-chain fatty acids act as antiinflammatory mediators by regulating prostaglandin E(2) and cytokines [J]. World J Gastroenterol, 15(44): 5549-5557, 2009.
35.Olefsky J M, et al., Macrophages,inflammation, and insulin resistance [J]. Annu Rev Physiol, 72:219-246, 2010.
36.Le Poul E, Loison C, Struyf S, et al., Functional characterization of human receptors for short chain acids and their role in polymorphonuclear cell activation [J]. J Biol Chem, 278(28): 25481-25489, 2003.
37.Pellizzaro C, Coradini D, Daidone M G. Modulation of Angio-genesis-related Proteins Synthesis by Sodium Butyrate in Colon Cancer Cell Line HT29 [J]. Carcinogenesis, 23(5): 735-740, 2002.
38.Basson M D, Turowski G A, Rashid Z, et al., Regulation of Human Colonic Cell Line Proliferation and Phenotype by Sodium Butyrate[J].Dig Dis Sci,41(10): 1989-1993, 1996.
39.Suzuki S, Hayashi Y, Wang Y, et al. Urokinase Type Plasminogen Activator Receptor Expression in Colorectal Neoplasms [J]. Gut, 43(6): 798-805, 1998.
40.Sowa Y, Sakai T. Butyrate as a model for gene regulating chemoprevention and chemotherapy [J]. Biofactors, 12(1-4): 283-287, 2000.
41.Chen ZY, Rex S, Tseng CC. Kruppel-like factor 4 is transactivated by butyrate in colon cancer cells [J]. The Journal of Nutrition, 134(4): 792-798, 2004.
42.Chen Y X, Fang J Y, Lu J, et al., Regulationg of histone acetylation on the expression of cell cycle-associated genes in human colon cancer cell lines [J]. Zhonghua Yi Xue Za Zhi,84(4): 312-317, 2004.
43.耿珊珊,蔡东联。短链脂肪酸对结肠肿瘤细胞增殖分化的影响 [J]。肠外与肠内营养。2005年9月:Vol 12,No 5。
44.Brian F. Hinnebusch, Shufen Meng, James T. Wu, Sonia Y. Archer, and Richard A. Hodin. The Effects of Short-Chain Fatty Acids on Human Colon Cancer Cell Phenotype Are Associated with Histone Hyperacetylation.
45.耿珊珊。短链脂肪酸对结肠肿瘤细胞增殖分化的影响。肠外与肠内营养,9(12): 295-298, 2005.
46.Levy P, Robin H, Bertrand F, et al., Butyrate‐treated colonic Caco‐2 cells exhibit defective integrin‐mediated signaling together with increased apoptosis and differentiation [J]. Journal of Cellular Physiology,197(3):336-347,2003.
47.Beyer-Sehlmeyer G, Glei M, Hartmann E, et al. Butyrate is only one of several growth inhibitors produced during gut flora-mediated fermentation of dietary fibre sources [J]. Br J Nutr,90(6): 1057-1070, 2003.
48.Hague A, Diaz GD, Hicks DJ, et al., bcl‐2 and bak may play a pivotal role in sodium butyrate‐induced apoptosis in colonic epithelial cells; however overexpression of bcl‐2 does not protect against bak‐mediated apoptosis [J]. International journal of Cancer, 72(5): 898-905, 1997.
#酒局守护神 #酉神1号 #酉神一号 #酉神壹号 #酒神1号 #酒神一号 #酒神壹号 #酉神1号解酒液 #酉神1号有机酸解酒液






