发布时间:2024-12-23 浏览:142次
心血管疾病(cardiovascular disease,CVD)已成为中国目前居民疾病死亡的首位原因。据统计,中国每5 例死亡患者有超过 2 例死于 CVD[1] 。
CVD 的发生发展受遗传和环境等复杂多因素的共同影响,其中环境因素占主要部分。饮食结构是人类最主要的环境暴露,在 CVD 的发生与发展中起重要作用。研究表明,富含蔬果、粗粮等高膳食纤维的饮食结构可改善多种 CVD,有利于心血管健康的发展 [2] 。
1 SCFAs 概述
1. 1 SCFAs 的生成、分布和代谢
SCFAs 是碳链中碳原子数为 1 ~6 的有机脂肪酸,主要包括乙酸、丙酸和丁酸。在人体中,SCFAs 主要是由肠道菌群代谢产生。特定的肠道菌群对未消化吸收的膳食纤维和抗性淀粉进行发酵,产生 SCFAs,大部分在近端结肠释放。
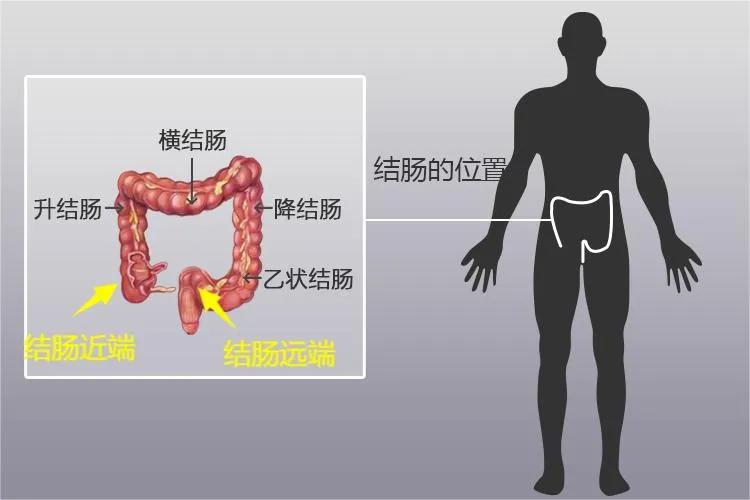
乙酸、丙酸和丁酸在结肠内的浓度比例约为 60 ∶ 25 ∶ 15,受饮食、菌群结构和宿主基因等因素影响[4] 。SCFAs 在人体肠道内被吸收进入肠上皮,其中丁酸主要被结肠上皮细胞吸收后作为其主要能量来源。而乙酸和丙酸通过血液循环进入肝脏,随后丙酸由肝细胞代谢,参与糖异生过程。乙酸主要释放到外周静脉系统,进入体循环,参与各器官的代谢[5]。
1. 2 SCFAs 受体
SCFAs 可通过结合 SCFAs 受体发挥作用。目前已发现的 SCFAs 受体主要为 G 蛋白偶联受体(G-
protein-coupled receptors,GPR),包括 GPR41、GPR43和 GPR109A。GPR41 和 GPR43 又被称为游离脂肪酸受体 3(free fatty acid receptor 3,FFAR3)和 FFAR2,广泛分布于全身,在肠道、免疫细胞和脂肪组织中表达量较高。
乙酸、丙酸和丁酸均可结合并激活 GPR41 和GPR43,参与调节器官的代谢、免疫和能量稳态。GPR109A 又称羟基羧酸受体 2,为丁酸和 β-羟基丁酸的特异性结合受体。其主要在肠上皮细胞、免疫细胞和脂肪细胞中表达,可参与调节结肠中免疫细胞稳态和脂肪组织中脂质代谢。
此外,近期研究发现,嗅觉感受受体(olfactory receptor,Olfr)78 为一种新发现的SCFAs 受体,主要分布于肾脏和血管,参与调节肾素的分泌,可与 GPR41、GPR43 相互拮抗共同调节机体的血压水平[6] 。
2 SCFAs 与 CVD
2. 1 SCFAs 与高血压
高血压是临床上最常见的 CVD,是多种心脑血管疾病和肾脏疾病的主要病因,其发病机制十分复杂,仍有待进一步探索。近年来研究表明,高血压的发生常伴随有肠道菌群失调,其主要特征是 SCFAs 产量减少和厚壁菌门比拟杆菌门比值升高 [7-8] 。
有病例报道显示,在难治性高血压患者中,使用二甲胺四环素抑制肠道微生物可产生强大的降血压效应 [9] 。有学者认为这一效应与 SCFAs 的产量密切相关[10] 。SCFAs可通过激活肾脏和血管平滑肌中的 Olfr78 受体和GPR41、GPR43 受体参与机体血压的调节。在两种高血压小鼠模型中(即自发性高血压大鼠模型和血管紧张素Ⅱ灌注模型),醋酸[11] 和丙酸 [12] 都可降低模型的血压水平。Marques 等[11] 发现给予高纤维饮食或添加醋酸盐的醋酸脱氧皮质酮-盐型高血压小鼠模型的收缩压与舒张压均较对照组有显著的降低。Pluznick等[12] 的研究表明静脉注射丙酸盐可激活肾小球旁器中的 Olfr78 受体,促进肾素分泌使血压升高,而在敲除 Olfr78 受体的小鼠中则未观察到上述变化;同时,丙酸盐也可激活肾脏和血管平滑肌中的 GPR41 受体使血压降低,而敲除 GPR41 受体的小鼠中也未观察到这一降压效应。进一步研究表明 Olfr78 受体能结合 G蛋白的 α 亚基增加环腺苷酸的生成,而 GPR41 受体可结合 Gai/o 亚基减少细胞内环腺苷酸的生成。二者相互拮抗,共同调节血压平衡。
大量动物模型研究结果表明,肠道微生物代谢产物 SCFAs 具有调节血压的作用,但由于物种的差异,目前 SCFAs 与人类高血压的关联性还需进一步证实。
2. 2 SCFAs 与动脉粥样硬化
动脉粥样硬化(atherosclerosis,AS)是危害人类心脑血管健康的主要疾病之一,其主要病因包括脂质代谢紊乱和血管内皮炎症反应的发生。AS 是动脉管壁的慢性炎症反应[13] ,主要表现为动脉管壁粥样斑块形成而使动脉弹性丧失,最终引起不良心血管事件。
近年来研究发现,AS 的发生与肠道微生物菌群变化密切相关[14-15] 。其中,产丁酸盐的 Roseburiam 菌种的数目与 AS 的严重程度呈反比。Kasahara 等[16] 的研究表明,与无菌小鼠相比,携带 Roseburiam 菌的小鼠喂食高纤维饮食后 AS 斑块明显减少,炎症反应也有所减轻。其机制为 SCFAs 可抑制组蛋白脱乙酰化酶的活性以及核因子 κB 和肿瘤坏死因子信号通路,降低由氧化型低密度脂蛋白激活的血管内皮合成的血管细胞黏附分子-1 与血管细胞间黏附分子-1 的表达量,保护血管内皮功能。同时,SCFAs 还可促进胆固醇转化为胆汁酸,从而延缓 AS 的进程。
2. 3 SCFAs 与心力衰竭
临床上,心力衰竭(heart failure,HF)是所有 CVD的终末状态。HF 与肠道功能改变的关联性已被广泛认可。目前,学术界普遍认为肠道细菌易位以及由此导致的炎症反应加剧,是肠道改变导致 HF 的主要诱因[17-18] 。
肠道菌群代谢所产生的 SCFAs 可通过以下机制影响 HF 的发生发展:
(1)促进黏液分泌间接改善肠道屏障功能,降低肠道细菌易位[19] ;
(2)调节血压(详见 2. 1);
(3)激活组蛋白乙酰转移酶,抑制组蛋白去乙酰化酶,平衡表观基因组的调节免疫细胞活化,达到抑制炎症的作用 [20]
此外,在临床前研究中也发现产生 SCFAs 的肠道微生物是治疗心肌肥厚和纤维化的潜在保护性干预靶点。在高纤维饮食或添加SCFAs 盐喂养的醋酸脱氧皮质酮小鼠高血压模型中,心脏纤维化程度均较对照组有明显的降低,心血管功能可得到明显的改善 [11] 。该研究还得出结论,上述SCFAs 受体在心脏转录组中难以被检测到。因此,SCFAs 能否通过其他独立机制调节心功能尚有待进一步研究。
2. 4 SCFAs 与肥胖
目前研究发现,肥胖是 CVD 的独立危险因素,它参与了高血压和冠心病等 CVD 的发生[21-22]。有研究表明,与体重正常者相比,肥胖人群粪便中的 SCFAs比例均有改变,低体重人群的粪便中乙酸盐比例相对较高[23] 。
Chambers 等 [24] 的临床研究发现,肥胖人群长期应用丙酸盐(每天补充 10 g 丙酸丙酯,连续 24周)可控制体重增长,减少脂肪堆积和肝内脂质沉积。其机制可能为 SCFAs 通过结合肠道表面的 GPR41/43受体,促进 5-羟色胺、胰高血糖素样肽 1(glucagon-likepeptide 1,GLP-1)和酪酪肽(peptide YY,PYY)等肠道激素的分泌,从而调节肠道功能,减少胃肠道对能量的吸收[25] 。GLP-1 可促进机体胰岛素分泌的同时提高胰岛素敏感性,降低胰岛素抵抗,增加机体能耗。PYY 可减缓胃排空,增加机体的饱腹感,减少摄食行为。Pirlich 等[26] 对 GPR43 敲除的小鼠饲以正常饮食,这些小鼠仍可发展为肥胖状态,而脂肪细胞中高表达 GPR43 受体的小鼠无论摄入何种饮食,体型均可维持正常。
3 SCFAs 在 CVD 中的干预方法
目前研究表明,机体 SCFAs 水平与 CVD 的发生及预后密切相关,增加 SCFAs 的产生可能成为治疗CVD 的潜在靶点。目前干预机体 SCFAs 产量的方法主要有以下几个方面。
3. 1 调整饮食结构
在一项高血压动物模型的实验中,Marques 等[11]发现给予高纤维饮食或添加醋酸盐的醋酸脱氧皮质酮-盐型高血压小鼠模型的收缩压和舒张压均较对照组显著降低。在临床研究中,饮食补充 SCFAs 也取得了有益的结果。在超重的女性患者中,饮食补充丙酸酯可对肥胖起到明显预防作用 [24] ;同样,在健康女性中,饮食补充丙酸盐(每天补充丙酸钠 7. 5 g,连续 7周)也可明显改善糖耐量[27] 。
在最近的一项研究中,Reynolds 等[28] 对超 240 项临床研究进行荟萃分析表明,与摄入膳食纤维少的人群相比,膳食纤维摄入量高的人群中冠心病、脑卒中等心脑血管疾病的发病率及死亡率均降低 15% 以上。尽管饮食结构影响对于SCFAs 及 CVD 的具体作用及其机制仍有待进一步探索,总体而言,增加膳食纤维的摄入或直接补充 SCFAs盐均可增加肠道微生物中产生 SCFAs 的菌群比例,增加相应 SCFAs 的产生,从而降低 CVD 的风险。
3. 2 口服益生菌
益生菌是对宿主健康有益的活的微生物,目前临床上常用的益生菌主要为乳酸菌和双歧杆菌。

双歧杆菌在碳水化合物缺乏时可通过糖酵解产生乙酸盐和甲酸盐,在碳水化合物充足时则产生乙酸盐和乳酸盐。双歧杆菌、乳酸菌等益生菌的生长和代谢受不同膳食成分的刺激,改变机体肠道微生物 SCFAs 的产生,这些细菌产生的 SCFAs 可调控肠道上皮细胞的增殖[29] 。
目前,尚缺乏用某种益生菌株调节 SCFAs 生产用来治疗 CVD 的相关研究。未来的研究必须阐明益生菌与 CVD 背后的机制,从而确定两者之间是否存在因果关系。
3. 3 菌群移植
粪菌移植(fecal microflora transplantation,FMT)已在临床上用于治疗炎症性肠病和代谢综合征等疾病[30] ,FMT 可通过增加微生物多样性,从而改变肠道菌群代谢产物的组成。尽管目前仍缺乏 FMT 治疗CVD 的相关报道,目前的研究已表明粪菌移植后的患者体内 SCFAs 的产量明显增加[31] 随着 SCFAs 与CVD 之间的关系进一步明确,FMT 有望成为 CVD 新的治疗思路。
4 展望与结论
目前的认识表明肠道微生物的代谢产物 SCFAs对 CVD 和代谢性疾病的各个方面均发挥着多种有益作用,然而目前对其潜在分子机制的研究仍不完善,缺乏相应的临床研究数据。因大多数研究数据均是从啮齿类动物身上获得,由于啮齿类动物与人类肠道和机体功能的差异,很多研究结果并不能直接应用于人类[32] 。由于肠道微生物群对于新的药物靶点来说是一个未知的领域,需对这些潜在作用和机制进行全面的了解,为 CVD 的靶向治疗策略铺平道路。
#参考文献#
[1] 胡盛寿,高润霖,刘力生,等 . 《中国心血管病报告 2018》概要[J]. 中国循
环杂志,2019,34(3):209-220.
[2] Tang WHW,Li DY,Hazen SL. Dietary metabolism,the gut microbiome,and
heart failure[J]. Nat Rev Cardiol,2019,16(3):137-154.
[3] Pluznick JL. Microbial short-chain fatty acids and blood pressure regulation
[J]. Curr Hypertens Rep,2017,19(4):25.
[4] Tazoe H,Otomo Y,Kaji I,et al. Roles of short-chain fatty acids receptors,
GPR41 and GPR43 on colonic functions[J]. J Physiol Pharmacol,2008,59
Suppl 2:251-262.
[5] Hu J,Lin S,Zheng B,et al. Short-chain fatty acids in control of energy metabo-
lism[J]. Crit Rev Food Sci Nutr,2018,58(8):1243-1249.
[6] Bolognini D,Tobin AB,Milligan G,et al. The pharmacology and function of re-
ceptors for short-chain fatty acids[J]. Mol Pharmacol,2016,89(3):388-398.
[7] Yang T,Santisteban MM,Rodriguez V,et al. Gut dysbiosis is linked to hyper-
tension[J]. Hypertension,2015,65(6):1331-1340.
[8] Li J,Zhao F,Wang Y,et al. Gut microbiota dysbiosis contributes to the develop-
ment of hypertension[J]. Microbiome,2017,5(1):14.
[9] Qi Y,Aranda JM,Rodriguez V,et al. Impact of antibiotics on arterial blood
pressure in a patient with resistant hypertension - A case report[J]. Int J Car-
diol,2015,201:157-158.
[10] Pluznick JL. Renal and cardiovascular sensory receptors and blood pressure reg-
ulation[J]. Am J Physiol Renal Physiol,2013,305(4):F439-F444.
[11] Marques FZ,Nelson E,Chu PY,et al. High-fiber fiet and acetate supplementa-
tion change the gut microbiota and prevent the development of hypertension and
heart failure in hypertensive mice[J]. Circulation,2017,135(10):964-977.
[12] Pluznick JL,Protzko RJ,Gevorgyan H,et al. Olfactory receptor responding to
gut microbiota-derived signals plays a role in renin secretion and blood pressure
regulation[J]. Proc Natl Acad Sci U S A,2013,110(11):4410-4415.
[13] Wu MY,Li CJ. New insights into the role of inflammation in the pathogenesis of
atherosclerosis[J]. Int J Mol Sci,2017,18(10),pii:E2034.
[14] Jonsson AL,Backhed F. Role of gut microbiota in atherosclerosis[J]. Nat Rev
Cardiol,2017,14(2):79-87.
[15] Li DY,Tang W. Gut microbiota and atherosclerosis[J]. Curr Atheroscler Rep,
2017,19(10):39.
[16] Kasahara K,Krautkramer KA,Org E,et al. Interactions between roseburia intes-
tinalis and diet modulate atherogenesis in a murine model[J]. Nat Microbiol,
2018,3(12):1461-1471.
[17] Kitai T,Tang WHW. Gut microbiota in cardiovascular disease and heart failure
[J]. Clin Sci (Lond),2018,132(1):85-91.
[18] Nagatomo Y,Tang WH. Intersections between microbiome and heart failure:re-
visiting the gut hypothesis[J]. J Card Fail,2015,21(12):973-980.
[19] Jakobsson HE,Rodriguez-Pineiro AM,Schutte A,et al. The composition of the
gut microbiota shapes the colon mucus barrier[J]. EMBO Rep,2015,16(2):
164-177.
[20] Hur KY,Lee MS. Gut microbiota and metabolic disorders[J]. Diabetes Metab
J,2015,39(3):198-203.
[21] Ortega FB,Lavie CJ,Blair SN. Obesity and cardiovascular disease[J]. Circ
Res,2016,118(11):1752-1770.
[22] Kachur S,Lavie CJ,de Schutter A,et al. Obesity and cardiovascular diseases
[J]. Minerva Med,2017,108(3):212-228.
[23] Schwiertz A,Taras D,Schafer K,et al. Microbiota and SCFA in lean and over-
weight healthy subjects[J]. Obesity (Silver Spring),2010,18(1):190-195.
[24] Chambers ES,Viardot A,Psichas A,et al. Effects of targeted delivery of propio-
nate to the human colon on appetite regulation,body weight maintenance and ad-
iposity in overweight adults[J]. Gut,2015,64(11):1744-1754.
[25] Tan J,McKenzie C,Potamitis M,et al. The role of short-chain fatty acids in
health and disease[J]. Adv Immunol,2014,121:91-119.
[26] Pirlich M,Schutz T,Kemps M,et al. Prevalence of malnutrition in hospitalized
medical patients:impact of underlying disease [J]. Dig Dis,2003,21 (3):
245-251.
[27] Venter CS,Vorster HH,Cummings JH. Effects of dietary propionate on carbohy-
drate and lipid metabolism in healthy volunteers [J]. Am J Gastroenterol,
1990,85(5):549-553.
[28] Reynolds A,Mann J,Cummings J,et al. Carbohydrate quality and human health:
a series of systematic reviews and meta-analyses [J]. Lancet,2019,393
(10170):434-445.
[29] LeBlanc JG,Chain F,Martin R,et al. Beneficial effects on host energy metabo-
lism of short-chain fatty acids and vitamins produced by commensal and probiot-
ic bacteria[J]. Microb Cell Fact,2017,16(1):79.
[30] Smits LP,Bouter KE,de Vos WM,et al. Therapeutic potential of fecal microbio-
ta transplantation[J]. Gastroenterology,2013,145(5):946-953.
[31] Seekatz AM,Theriot CM,Rao K,et al. Restoration of short chain fatty acid and
bile acid metabolism following fecal microbiota transplantation in patients with
recurrent Clostridium difficile infection[J]. Anaerobe,2018,53:64-73.
[32] Pouteau E,Nguyen P,Ballevre O,et al. Production rates and metabolism of
short-chain fatty acids in the colon and whole body using stable isotopes[J].
Proc Nutr Soc,2003,62(1):87-93.
#酒局守护神 #酉神1号 #酉神一号 #酉神壹号 #酒神1号 #酒神一号 #酒神壹号 #酉神1号解酒液 #酉神1号有机酸解酒液






