发布时间:2024-12-12 浏览:150次
(本文来源于国际消化病杂志,作者郭悦承、陆伦根)
非酒精性脂肪性肝病是一种常见的、多因素导致的肝病,包括肝细胞脂肪变性、肝细胞损伤、非酒精性脂肪性肝炎和肝纤维化等。
目前认为,肠道菌群失调可通过破坏肠道屏障、影响机体胆汁酸与胆碱代谢、增加内源性乙醇等途径参与非酒精性脂肪性肝病的进展。
除了菌群本身,其代谢物也可影响代谢及宿主免疫系统。肠道微生物群可以产生维生素和多种营养素,包括短链脂肪酸。
短链脂肪酸是肠道菌群分解未消化的膳食纤维产生的代谢产物,包括乙酸、丙酸、乳酸、丙酮酸、琥珀酸、马来酸、富马酸、苹果酸、酒石酸、柠檬酸、戊酸、己酸等。正常菌群每日可产生50~100mmol/L的短链脂肪酸[1],为肠道上皮细胞提供能量。
短链脂肪酸可通过降低结肠pH、抑制病原体生长、促进水钠吸收等途径参与肠道免疫稳态的调控。多项研究表明,短链脂肪酸影响了非酒精性脂肪性肝病的进展,本文将从肠道屏障、脂代谢、免疫炎性反应、肠道动力学、胆汁酸代谢等方面作进一步阐述。

短链脂肪酸在非酒精性脂肪性肝病进展过程中的作用
短链脂肪酸作为肠道菌群分解未消化的膳食纤维产生的代谢产物,可影响非酒精性脂肪性肝病的进展。
乙酸盐可减轻非酒精性脂肪性肝炎小鼠的肝脏脂肪变性和炎性浸润,并降低血清中、三酰甘油、游离脂肪酸和胆固醇的水平[2];
丙酸可通过抑制β细胞凋亡而增强葡萄糖刺激的胰岛素释放[3];
补充丁酸钠可促进肠道紧密连接蛋白表达,减轻肝损伤,抑制小鼠非酒精性脂肪性肝炎的进展[4]。
1保护肠道屏障功能
非酒精性脂肪性肝病伴随着严重的肠道屏障损伤。
紧密连接是胃肠道黏膜上皮机械屏障的重要组成部分,位于相邻上皮细胞间,可以阻止肠道微生物及其代谢产物进入门静脉系统[5]。
非酒精性脂肪性肝病患者的肠道屏障完整性受损,紧密连接蛋白表达下降,小肠细菌过度生长且与肝脂肪变性的严重程度有关[6]。
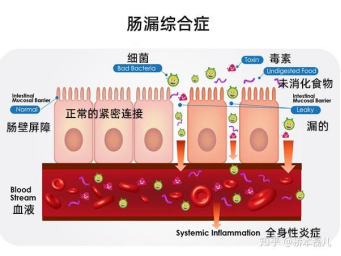
已有研究证实短链脂肪酸可通过多种途径影响肠道屏障功能。
短链脂肪酸有助于肠道屏障的形成,并可通过抑制炎性小体NLRP3和自噬,减轻肠道屏障损伤[7];肠道上皮吸收丁酸盐,可通过恢复缺氧诱导因子的表达,纠正生理性缺氧并维持肠道屏障功能[8];丁酸盐可抑制MLCK/MLC2通路,促进蛋白激酶CβII(PKCβ2)磷酸化,从而促进紧密连接蛋白重组,上调肠道上皮紧密连接蛋白ZO-1、occludin的表达[9];丁酸盐也可作为组蛋白去乙酰化酶抑制剂激活信号转导及转录激活因子3(STAT3)通路,诱导白细胞介素-10受体α抗体(IL-10RA)表达升高,下调claudin-2的表达[10],提高跨膜电阻值(TEER),促进肠道屏障形成。
2改善脂代谢
在动物模型中,短链脂肪酸可调节肝脏脂质代谢。
摄入乙酸可促进胆汁酸排泄,抑制肝脏中脂质合成,并且可以降低胆固醇饮食大鼠的血清胆固醇和TG水平[11]。有学者提出,乙酸降低血脂、改善肝脏炎性反应程度、延缓肝纤维化的作用是通过激活法尼醇受体(FXR)来实现的[2]。
此外,乙酸与丙酸混合饮食可降低脂肪生成基因的表达,在不影响体质量的条件下降低高脂饮食小鼠肝脏中TG水平,而且丙酸含量越高,胰岛素敏感度的改善越明显[12]。
Ge等[13]的研究结果显示,乙酸具有抑制脂肪细胞分解、降低血浆游离脂肪酸、促进脂肪细胞分化的作用,而这些作用与G蛋白偶联受体43(GPR43)的激活有关。
丁酸盐可抑制脂肪细胞中的脂解作用[14],其机制主要涉及胞浆型磷脂酶A2(cPLA2)和环氧合酶(COX)活性的上调,以及前列腺素E2(PGE2)的表达升高[15]。
此外,乙酸、丙酸、丁酸的混合饮食可降低过氧化物酶体增殖物激活受体γ(PPARγ)的表达,使脂肪组织及肝组织由脂肪生成向脂肪酸氧化转变[16],从而缓解C57BL/6J小鼠高脂饮食诱发的肥胖和胰岛素抵抗。

3调节免疫应答和炎性反应
肠道短链脂肪酸可影响免疫应答。
丙酸盐可通过激活GPR41受体参与骨髓造血,促进巨噬细胞和树突状细胞前体的产生[17];丁酸盐可促进Foxp3基因转录并降低树突状细胞内促炎细胞因子的表达,从而诱导结肠固有层中调节性T细胞(Treg)分化,调节黏膜T细胞,抑制炎性反应[18-19];戊酸盐可通过AKT/mTOR通路抑制CD4+T细胞中HDAC活性,促进IL-10表达,减少IL-17A产生,改善炎性反应[20]。
短链脂肪酸可参与调节炎性细胞因子。
在脂肪细胞与巨噬细胞的共培养体系中,游离脂肪酸和甘油诱导炎性细胞因子TNF- α、IL-6、人单核细胞趋化蛋白(MCP-1)表达升高,但这一效应可被丁酸盐抑制,这可能是因为丁酸盐抑制了丝裂原活化蛋白激酶的磷酸化及核因子-kB(NF-kB)的活性[20]。
另一项研究指出,db/db 小鼠腹腔注射丁酸盐,可通过抑制NLRP3炎性信号通路而下调皮下脂肪组织中IL-1、TNF-α、IL-6mRNA的表达[21]。体外应用乙酸盐和丁酸盐干预小鼠巨噬细胞系(RAW264.7)可抑制NF-kB和ERK信号通路,升高IL-10表达,下调一氧化氮合酶、TNF-α、IL-6的表达[22]。
以上研究提示,短链脂肪酸在体内外均可参与调节炎性因子的产生,在炎性反应过程中发挥巨大的作用。
4影响肠道动力学
短链脂肪酸可通过调节肠源性肽分泌而影响肠道蠕动。
结肠注入菊粉丙酸酯可促进胰高血糖素样肽-1(GLP-1)和酪酪肽(PYY)分泌[23]。NAFLD患者长期补充菊粉丙酸酯可防止体质量及腹腔内脂肪组织增加,减少肝内脂质含量并改善葡萄糖稳态[24]。
在GPR41缺陷小鼠模型中,GPR41缺失与PYY表达下调、肠道转运率升高、能量摄取率降低有关[25]。Musso等[26]提出,GPR41和GPR43被乙酸、丙酸盐、丁酸盐等短链脂肪酸激活后,可刺激PYY分泌,抑制肠道运动,减慢肠道运输,从而增强营养吸收。

5影响胆汁酸代谢
短链脂肪酸影响肝肠循环的途径与FXR有关。
胆汁酸是重要的细胞信号分子,可通过FXR、跨膜G蛋白偶联胆汁酸受体5(TGR5)、维生素D受体等影响胆固醇代谢及肠道菌群[27]。
肠道菌群可通过改变胆汁酸池的组成及小肠中的FXR天然拮抗机制来抑制胆汁酸合成,在调节胆汁酸平衡中发挥重要作用[28]。
有研究指出,FXR受体缺乏的小鼠在接受高脂饮食后,产丁酸盐细菌丰度下降,β-鼠胆酸(β-MCA)和脱氧胆酸(DCA)水平显著升高。而摄入丁酸盐可降低β-MCA和DCA水平,并下调肝脏炎性基因(CCL17、CCL20、CCL2、TIMP1)的表达[29]。以上研究提示丁酸盐对肝脏炎性反应的治疗作用可能与胆汁酸受体FXR相关。
结语
随着肥胖、糖尿病、高脂血症等代谢性疾病的发病率逐年上升,非酒精性脂肪性肝病已成为威胁人类健康的常见肝病之一。短链脂肪酸作为肠道菌群酵解碳水化合物的产物,具有不可忽视的作用。
短链脂肪酸可上调紧密连接蛋白表达,促进肠道屏障形成,降低血脂,改善脂代谢,调节免疫应答和炎性反应,影响GLP-1和PYY的分泌而改变肠道蠕动,间接激活FXR受体从而影响胆汁酸代谢,以上途径均可能影响非酒精性脂肪性肝病的发生发展。
因此,短链脂肪酸可作为非酒精性脂肪性肝病新型疗法的潜在靶点。
参考文献:
[1] Duncan SH, Louis P, Thomson JM, et al, The role of pH indetermining the species composition of the human colonicmicrobiota[J]. Environ Microbiol, 2010, 11(8):2112-2122.
[2] Meng Q, Duan XP, Wang CY, et al, Alisol B 23-acetateprotects against nonalcoholic steatohepatitis in mice viafarnesoid X receptor activation[J], Acta Pharmacol Sin, 2017, 38(1):69-79.
[3] Pingitore A, Chambers ES, Hill T, et al, The diet-derivedshort chain fatty acid propionate improves betacell function inhumans and stimulates insulin secretion from human islets invitro[J]. Diabetes Obes Metab, 2017, 19(2):257-265.
[4] Jin CJ, Sellmann C, Engstler AJ, et al, Supplementation ofsodium butyrate protects mice from the development of nonalcoholic steatohepatitis (NASH)[J]. Br J Nutr, 2015, 114(11):1745-1755.
[5] Peterson LW, Artis D, Intestinal epithelial cells: regulators ofhomeostasis [J]. Nat Revbarrier function and immuneImmunol, 2014, 14(3):141-153.
[6] Miele L, Valenza V, La Torre G, et al, Increased intestinalpermeability and tight junction alterations in nonalcoholic fattyliver disease[J], Hepatology, 2009, 49(6):1877-1887.
[7] Feng Y, Wang Y, Wang P, et al, Shortchain fatty acidsmanifest stimulative and protective effects on intestinal barrierfunction through the inhibition of NLRP3 inflammasome andautophagy[J]. Cell Physiol Biochem, 2018, 49(1): 190-205.
[8] Kelly C, Zheng l, Campbell El, et al. Crosstalk betweenmicrobiota-derived short-chain fatty acids and intestinal epithelialHIF augments tissue barrier function[J], Cell Host Microbe, 2015,17(5):662-671.
[9] Miao W, Wu X, Wang K, et al. Sodium butyrate promotesreassembly of tight junctions in Caco-2 monolayers involvinginhibition of MLCK/MLC2 pathway and phosphorylation ofPKCp2[1]. Int J Mol Sci, 2016, 17(10). pii: E1696.
[10] Zheng L, Kelly C, Battista KD, et al. Microbial-derivedbutyrate promotes epithelial barrier function through I-10receptor-dependent repression of claudin-2. J lmmunol, 2017, 199(8):2976-2984.
[11] Fushimi T, Suruga K, Oshima Y, et al. Dietary acetic acidreduces serum cholesterol and triacylglycerols in rats fed acholesterol-rich diet[J], BrJ Nutr, 2006, 95(5):916-924.
[12] Weitkunat K, Schumann S, Nickel D, et al. Importance ofpropionate for the repression of hepatic lipogenesisandimprovement of insulin sensitivity in highfat diet-inducedobesity[J]. Mol Nutr Food Res, 2016,60(12):2611-2621.
[13] Ge H, Li X, Weiszmann J, et al, Activation of G proteincoupled receptor 43 in adipocytes leads to inhibition of lipolysisand suppression of plasma free fatty acids[J]. Endocrinology, 2008, 149(9):4519-4526.
[14] Ohira H, Fujioka Y, Katagiri C, et al. Butyrate attenuates inflammation and lipolysis generated by the interaction ofadipocytes and macrophages[J]. J Atheroscler Thromb, 2013 , 20(5):425-442.
[15] Ohira H, Tsutsui W, Mamoto R, et al, Butyrate attenuateslipolysis in adipocytes cocultured with macrophages throughnon-prostaglandin E2-mediated and prostaglandin E2-mediatedpathways[J]. Lipids Health Dis,2016,15(1):213.
[16] den Besten G, Bleeker A, Gerding A, et al, Short-chain fattyacids protect against highfat diet-induced obesity via a PPARy-dependent switch from lipogenesis to fat oxidation[J]. Diabetes, 2015, 64(7):2398-2408.
[17] Trompette A, Gollwitzer ES, Yadava K, et al. Gut microbiotametabolism of dietary fiber influences allergic airway disease andhematopoiesis[J]. Nat Med, 2014, 20:159-166.
[18] Furusawa Y, Obata Y, Fukuda S, et al, Commensal microbederived butyrate induces the differentiation of colonic regulatory T cells[J]. Nature, 2013, 504:446-450.
[19] Arpaia N, Campbell C, Fan X, et al, Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation[J]. Nature, 2013, 504(7480):451-455.
[20] Luu M, Pautz S, Kohl V, et al. The short-chain fatty acid pentanoate suppresses autoimmunity by modulating the metabolic-epigenetic crosstalk in lymphocytes [J]. Nat Commun, 2019, 10(1):760.
[21] Wang X, He G, Peng Y, et al. Sodium butyrate alleviates adipocyte inflammation by inhibiting NLRP3 pathway[J]. SeiRep, 2015, 5:12676.
[22] Park JS, Lee EJ, Lee JC, et al, Antiinflammatory effects of short chain fatty acids in lFN-y-stimulated RAW 264.7 murine macrophage cells:involvement of NF-kB and ERK signaling pathways[J]. Int Immunopharmacol, 2007, 7(1):70-77.
[23] Chambers ES, Viardot A, Psichas A, et al. Effects of targeteddelivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults[J]. Gut, 2015, 64(11):1744-1754.
[24] Samuel BS, Shaito A, Motoike T, et al, Effects of the gutmicrobiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, Gpr41[J]. Proc Natl Acad Sci U S A, 2008, 105(43):16767-16772.
[25] Musso G, Gambino R, Cassader M, Obesity, diabetes, and gut microbiota: the hygiene hypothesis expanded?[J]. Diabetescare, 2010, 33(10):2277-2284.
[26] Schaap FG, Trauner M, Jansen PL. Bile acid receptors as targetsfor drug development[J], Nat Rev Gastroenterol Hepatol, 2014,11:55-67.
[27] Sayin Sl, Wahlstróm A, Felin J, et al, Gut microbiota regulatesbile acid metabolism by reducing the levels of tauro-betamuricholic acid, a naturally occurring FXR antagonist[J]. Cell Metab, 2013, 17(2):225-235.
[28] Sheng l, Jena PK, Hu Y, et al. Hepatic inflammation causedby dysregulated bile acid synthesis is reversible by butyrate supplementation[J]. J Pathol, 2017, 243(4):431-441.
#酒局守护神 #酉神1号 #酉神一号 #酉神壹号 #酒神1号 #酒神一号 #酒神壹号 #酉神1号解酒液 #酉神1号有机酸解酒液






