发布时间:2024-12-18 浏览:114次
肠道微生物群是人体内最复杂的群落之一,估计约有 1000 种不同的微生物物种编码基因,其基因数量是人类基因组的 100 倍,并且表现出复杂的功能多样性[1] 。
正常的人类肠道微生物主要由 5个门组成,其中厚壁菌门占 79.4%,拟类杆菌门占16.9%,放线菌门占 2.5%,变形菌门占 1%,疣微菌门占 0.1% [2]
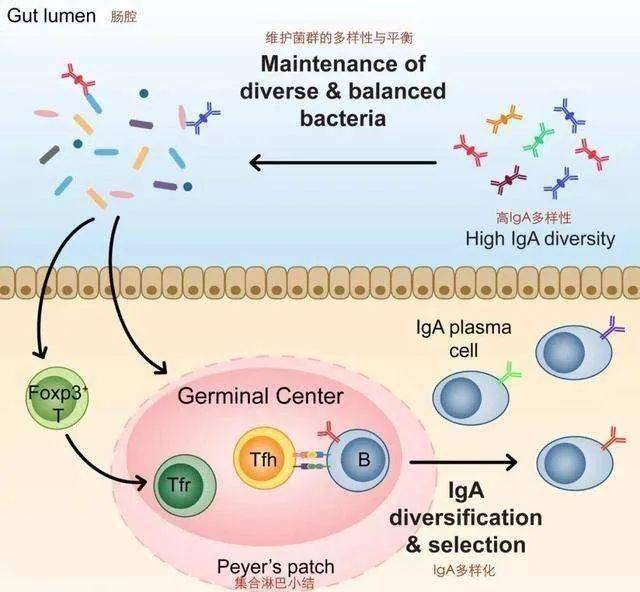
肠道菌群、上皮细胞和免疫细胞之间的互作
近年来研究发现失调的肠道菌群与免疫性疾病和血液疾病的发生有关,肠道菌群失调影响人体的免疫稳态。
1 肠道菌群引起免疫疾病的机制
许多研究发现患有免疫性疾病的人群存在肠道菌群失调,因此而引起的短链脂肪酸(short - chain fattyacid,SCFA)的代谢异常对免疫性疾病的发生存在作用。SCFA主要为乙酸盐、丙酸盐与丁酸盐,由肠道菌群发酵膳食纤维产生[3] 。Giongo 等 [4]研究发现,患有免疫性疾病的儿童肠道菌群在门水平上,厚壁菌门下降和拟杆菌门增加,这与健康者形成对比,在系统性红斑狼疮(SLE)的人群中也观察到类似的变化[5] 。在较低的分类水平上也观察到了一些差异,如 SLE 人群肠球菌属增多,而梭菌属、乳球菌属减少,同时还指出肠道菌群代谢物 SCFA 对于SLE 患者具有保护作用[6] 。而对炎症性肠病(IBD)的研究也证实了这一点[7] 。
多项研究采用16S rRNA测序分析及高通量 DNA 测序等方法发现患有 IBD的人群变形菌、放线菌和梭杆菌门丰度增加,厚壁菌门、拟杆菌门和疣微菌门丰度下降;与变形菌和放线菌门的比例相比,厚壁菌门和拟杆菌门的比例有所下降;在属的水平上,粪肠球菌属、玫瑰球菌属、乳球菌属和阿克曼菌属等丰度较低,而埃希氏菌属、肠球菌属和链球菌属丰度较高[8-9] ,同时 IBD患者存在肠道SCFA的的变化[10-11] 。在de Groot等 [12]的研究中,粪便分析显示患有免疫性疾病的人群与健康对照组相比,产生 SCFA 的菌群减少,粪便中SCFA的水平降低,同时血浆中SCFA的水平也较低,肠道菌群失调主要是通过 SCFA 的代谢异常引起免疫失调。
短链脂肪酸影响肠道屏障
SCFA 对肠道屏障的完整性有重要作用[13] 。Harbison等[14]发现,患有免疫性疾病的人群与健康对照者相比肠道的渗透性增加,同时存在肠道菌群失调及 SCFA 减少,从而指出肠道菌群失调引起的 SCFA减少可能会损害肠道上皮的完整性,增加肠道渗透性,从而使膳食抗原和免疫刺激剂(如内毒素)进入循环,促进全身炎症和异常免疫。肠屏障是由肠上皮细胞、肠上皮干细胞、潘氏细胞和杯状细胞组成的物理屏障、这些细胞分泌的抗菌肽、黏蛋白和IgA 组成的化学屏障及各种免疫细胞(单核巨噬细胞、T 细胞、B 细胞和树突状细胞) 组成的免疫屏障组成。SCFA可以通过 G 蛋白偶联受体调节 T 细胞分化、下调肿瘤坏死因子及白介素等促进肠上皮细胞的增殖,保护肠道屏障[15] 。
Wang等 [16] 研究发现,SCFA 的减少使小鼠结肠中肌动蛋白结合蛋白突触素(SYNPO)的表达缺失,而丁酸盐的补充挽救了这种缺失。SYNPO 位于肠上皮紧密连接处和肌动蛋白应激纤维内,是由 SCFA 调节的肠上皮紧密连接蛋白,它可以调节屏障完整性并促进损伤后的上皮修复,对屏障完整性和细胞运动至关重要,可能的机制是丁酸盐抑制组蛋白去乙酰化酶(histonedeacetylase,HDAC)诱导肠上皮细胞表达 SYNPO。
短链脂肪酸与宿主免疫
IgA 免疫反应
Huang 等[17]发现,SCFA可能调节细菌反应性 IgA免疫反应。患有免疫性疾病人群粪便中 SCFA 的浓度与血清 IgA 成负相关,主要原因可能是 SCFA 抑制脾细胞中白介素(IL) - 6 的表达,而 IL - 6 是 B 细胞分化、成熟和存活所必需的。由此推测,IgA免疫反应改变由肠道微生物群衍生的SCFA 介导,这为免疫性疾病的发病机制提供了新见解,但是具体机制尚不清楚,可能的原因是异常的IgA免疫反应与肠道屏障的减弱及肠道通透性增加有关。
树突状细胞
树突状细胞(DC)是重要的抗原呈递细胞,是 T 细胞启动和分化的关键免疫调节因子。SCFA可以直接诱导 DC,从而抑制干扰素 - γ及IL - 6的表达,减少Th17的表达,抑制异常免疫反应,Xiao 等[18]的小鼠实验证实了这一点,主要机制可能是 SCFA可以调节 DC 表面人类白细胞 II 类抗原(MHC - II)和共刺激分子 CD86、CD80 和 CD40 的表达。
Xiu 等[19]研究发现,患有免疫性疾病人群中DC 衍生的双调节蛋白(AREG)表达显著降低,丁酸盐通过 G 蛋白偶联受体(GPR43)/ B 淋巴细胞诱导成熟蛋白-1(Blimp - 1)信号调节 DC 表达 AREG,Blimp - 1作为 GPR43 的关键下游转录因子发挥作用。
AREG 是表皮生长因子(EGF)家族的一种,被认为是细胞增殖和组织修复的关键调节因子。AREG 通过与靶细胞(包括 T 细胞、上皮细胞和纤维细胞)表达的表皮生长因子受体(EGFR)结合来发挥其功能[20] ,而其中的具体机制还不明确。Nakano 等[21]的 1项小鼠实验发现乙酸盐对上皮细胞的调节途径可能通过 C - Jun N - 末端激酶 JNK 效应和随后的Rho 激活的调节。
调节性 T 细胞
SCFA 在体外研究实验中可以促进初始 T 细胞向调节性 T 细胞(Treg)转化。Arpaia等[22]研究发现,在体外环境中 SCFA 刺激初始 T 细胞诱导 Foxp3 转录因子表达,促进 Treg 分化。SCFA可能是通过直接刺激 T 细胞促进 Treg 分化,具体机制为 SCFA 通过抑制 HDAC 活性,促进 Treg 分化。Sivaprakasam等[23]的小鼠实验发现,主要存在于结肠上皮细胞中的钠偶联单羧酸转运蛋白 SLC5A8 的缺失会导致小鼠易患结肠炎症,而肠道 SCFA含量较低的时候,SLC5A8 对 SCFA 进入结肠上皮细胞是必需的。
Singh 等[24]研究证实,丁酸盐和丙酸盐通过SLC5A8 进入细胞,直接抑制 HDAC 而影响转录调节,从而促进 Treg 分化,抑制效应性 T 细胞的活性。SCFA 对 Treg 细胞功能的调节也可能依赖于Ffar2,Ffar2 为 G 蛋白偶联受体[25] ,通过级联反应如丝裂原活化蛋白激酶(MAPK)途径,而抑制 HDAC 活性,HDAC 包含 18 种已知的酶,可以从结合 DNA 的组蛋白尾部去除乙酰基。SCFA 增加组蛋白 H3 乙酰化来促进 Treg 细胞分化,从而发挥抗炎作用[26] 。Chen 等[27]的研究也发现了SCFA 过抑制 HDAC来促进 Treg 的分化。
白介素 - 22
近几年研究发现芳香烃受体(AHR)在免疫性疾病的发病机制中起作用。AHR 在肠道的免疫和非免疫细胞中表达,通过与配体结合,细胞质中的 AHR 转移到细胞核,从而诱导 CD4 + T 细胞及先天淋巴细胞(ILC)产生大量白细胞介素-22,白介素-22 能够通过维持肠上皮的完整性来控制生物失调中的细菌易位,而 SCFA 能够促进AHR 与配体的结合[28] 。AHR 结合的配体主要为经吲哚途径产生的 5 - 羟色胺(5 - HT)。摄入的食物经肠道菌群代谢产生色氨酸,色氨酸经吲哚途径产生 5 - HT与AHR 结合[29]
TLR7 - pDC - IFN
Zegarra - Ruiz等[30] 研究结果显示,SCFA 减少了路氏乳杆菌引起的肠道渗漏,可能是通过 SCFA 的屏障收紧作用,从而抑制了体内 TLR7/干扰素(IFN)途径,而 TLR7/IFN 核心轴的异常是许多免疫性疾病的主要发病机制。此项研究通过高纤维饮食增加 SCFA,降低肠道路氏乳杆菌的丰度,减少肠道渗漏,调节体内 I 型 IFN 和促炎反应,从而防止免疫性疾病的发展并降低死亡率,但是其中具体机制还有待进一步研究。
2 肠道菌群失调与免疫性血小板减少症
免疫性血小板减少症(ITP)是一种以外周血小板破坏增加和血小板生成减少为特征的自身免疫性疾病。ITP 是一种复杂的异质性自身免疫性疾病,近几年的研究发现,ITP 患者存在细胞免疫和体液免疫的免疫紊乱,包括自然杀伤细胞(NK)、DC、T细胞及 B 细胞,导致抗血小板自身抗体的产生,从而促进脾脏巨噬细胞对血小板的吞噬作用。
由于针对巨核细胞的异常免疫反应,血小板生成不足也会加剧血小板减少症,甚至 ITP 患者中血小板生成素(TPO)的相对缺乏也促进了疾病的发生[31] 。近几年随着肠道菌群的研究发展,越来越多的证据指向肠道菌群的失调可能是 ITP 发生的影响因素,但是目前研究尚少,具体机制还尚未明确,而 SCFA 的减少可能是其中原因之一。
免疫性血小板减少症发病机制
淋巴细胞亚群失衡
淋巴细胞在 ITP 发病中的作用已经明确,众多研究证实了ITP 患者体液免疫及细胞免疫的异常,包括 T 细胞及 B 细胞亚群失衡等。Fang 等[32]在儿童 ITP 的研究中发现,调节性 B 细胞(Regulatory B cells,Breg)与记忆性 B 细胞(MemoryB cells,Bmem)亚群失衡。
该研究发现在新诊断的 ITP 病例中,CD19 + CD27 + Bmem 显著 升高, 而CD19 + CD24 hi CD38 hi Breg 显著降低,而经治疗后它们的比例恢复正常。关于 ITP 患者中 T 淋巴细胞的研究较多,许多研究发现了 Treg、Th1、Th2 及 Th17比例失调。一项体外实验指出 Treg 可抑制 CD4 + T细胞的增殖,并增强CD4 + CD45RO + T细胞的凋亡[33] 。Lu 等[34]研究发现,与健康对照组比较,ITP 患者外周血CD4 + CD25 + Treg 是下调的,而经治疗后 Treg 水平恢复,同时还指出 CD4 + CD25 + Treg 细胞中 CD39的表达降低,经大剂量地塞米松治疗后,Treg 细胞CD39 表达增加。同时 ITP 患者 T 细胞亚群的失衡还表现在 Th1/Th2 和 Treg/Th17免疫细胞失衡[35] 。
异常组蛋白去乙酰化与 ITP
SCFA 是一种 HDAC 抑制剂,可以促进 Treg 分化[36] 。Zhao等 [37]研究发现,ITP 可能与 CTLA4 基因 H3K27 的异常组蛋白乙酰化有关。他们发现 ITP 患者的组蛋白 H3K27 乙酰化程度低于对照组,并证实低剂量 HDAC 抑制剂如西达本胺通过调节组蛋白 H3K27 乙酰化来调节CTLA4 的表达,还发现低剂量 HDAC 抑制剂减弱了巨噬细胞对抗体包被的血小板的吞噬作用,刺激了天然 Foxp3 + Treg 的产生,促进了外周 T 细胞向 Treg的转化,并在体内和体外恢复了Treg 抑制功能,同时调节外周血单个核细胞(PBMC)中 CTLA4 的表达。ITP 患者存在异常组蛋白去乙酰化,而 SCFA对 HDAC 的抑制作用已经明确,但目前还没有关于SCFA 在 ITP 患者中的作用方面的研究。
肠道菌群失调与血小板数
Zhang 等[38]研究发现,ITP 患者肠道中厚壁菌门中的乳杆菌属、链球菌属得到了富集,而拟杆菌门减少,厚壁菌门与拟杆菌门的比率升高。异常的肠道菌群与血小板数有关,如乳杆菌属及链球菌属与血小板数呈高度负相关,而拟杆菌与血小板数呈高度正相关。该项研究还发现,ITP 患者中存在肠道代谢物的异常。拟杆菌的成员主要是革兰氏阴性菌,大多定居在远端肠道,它们可以发酵难消化的多糖,产生 SCFA。
肠道菌群失调在 ITP的发生中存在作用
Liu 等[39]研究发现,肠道微生物群与血小板数之间存在联系,如在门水平上,血小板数与厚壁菌门呈正相关(P<0.001)。肠道菌群失调在 ITP的发生中存在作用已经明确,而肠道菌群失调引起的 SCFA 代谢异常对宿主的免疫失调作用也有众多研究,但是关于 SCFA 对 ITP 的影响目前缺乏深入的研究,而其中的具体机制也有待于进一步的研究。
3 展 望
肠道菌群失调引起的免疫性疾病主要与 SCFA 的产生减少有关,而饮食中添加膳食纤维,可以调节肠道微生物群,使得 SCFA 的含量增加。
肠道菌群对人体疾病的影响
在 IBD及SLE 中 SCFA 的研究较多,虽然目前关于肠道菌群失调以及 SCFA 在 ITP 中的研究尚少,但是 ITP 的发病过程存在免疫失调已经明确,而且 ITP 患者存在异常组蛋白去乙酰化,低剂量组蛋白去乙酰化酶抑制剂可纠正这种异常,SCFA 对 HDAC 的抑制作用也已经明确,因此认为肠道菌群失调引起 SCFA 产生减少在 ITP 的发生中存在作用。
目前许多研究从饮食、肠道微生物、机体免疫等方面入手探索菌群失调引起的 SCFA 异常具体在体内发挥怎样作用,而未来了解 SCFA 是如何整合到 T 细胞的免疫代谢中以确定可能在免疫性疾病治疗上接近的特定代谢靶点是至关重要的。
#参考文献#
【1 】Ley RE, Peterson DA, Gordon JI. Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell,2006, 124(4): 837-848.
【2】 Tap J, Mondot S, Levenez F, et al. Towards the human intestinal microbiota phylogenetic core. Environ Microbiol, 2009, 11(10):2574-2584.
【3】 Blaak EE, Canfora EE, Theis S, et al. Short chain fatty acids in human gut and metabolic health. Benef Microbes, 2020, 11(5):411-455.
【4】 Giongo A, Gano KA, Crabb DB, et al. Toward defining the autoimmune microbiome for type 1 diabetes. ISME J, 2011, 5(1):82-91.
【5】 Guo M, Wang H, Xu S, et al. Alteration in gut microbiota is associated with dysregulation of cytokines and glucocorticoid therapy in systemic lupus erythematosus. Gut Microbes, 2020,11(6): 1758-1773.
【6】 He J, Chan T, Hong X, et al. Microbiome and metabolome analyses reveal the disruption of lipid metabolism in systemic lupus erythematosus. Front Immunol, 2020, 11: 1703.
【7】 Healey GR, Celiberto LS, Lee SM, et al. Fiber and prebiotic interventions in pediatric inflammatory bowel disease: what role does the gut microbiome play?. Nutrients, 2020, 12(10): 3204.
【8 】Hu S, Vich Vila A, Gacesa R, et al. Whole exome sequencing analyses reveal gene - microbiota interactions in the context of IBD.Gut, 2021, 70(2): 285-296.
【9】 Lo S asso G, Khachatryan L, Kondylis A, et al. Inflammatory bowel disease - associated changes in the gut: focus on Kazan patients. Inflamm Bowel Dis, 2021, 27(3): 418-433.
【10 】Hertati A, Hayashi S, Ogata H, et al. Morphological elucidation of short - chain fatty acid receptor GPR41 - positive enteric sensory neurons in the colon of mice with dextran sulfate sodium - induced colitis. Heliyon, 2020, 6(12): e05647 .
【11 】Ferrer - Picón E, Dotti I, Corraliza AM, et al. Intestinal inflammation modulates the epithelial response to butyrate in patients with inflammatory bowel disease. Inflamm Bowel Dis,2020, 26(1): 43-55 .
【12】 de Groot PF, Belzer C, Aydin Ö, et al. Distinct fecal and oral microbiota composition in human type 1 diabetes, an observational study. PLoS One, 2017, 12(12): e0188475.
【13 】Wu C, Pan LL, Luo Y, et al. Low methoxyl pectin protects against autoimmune diabetes and associated caecal dysfunction. Mol Nutr Food Res, 2019, 63(21): e1900307.
【14 】Harbison JE, Roth - Schulze AJ, Giles LC, et al. Gut microbiome dysbiosis and increased intestinal permeability in children with islet autoimmunity and type 1 diabetes: A prospective cohort study.Pediatr Diabetes, 2019, 20(5): 574-583.
【15 】Liu W, Luo X, Tang J, et al. A bridge for short - chain fatty acids to affect inflammatory bowel disease, type 1 diabetes, and non -alcoholic fatty liver disease positively: by changing gut barrier. EurJ Nutr, 2021, 60(5): 2317-2330.
【16】 Wang RX, Lee JS, Campbell EL, et al. Microbiota - derived butyratedynamically regulates intestinal homeostasis through regulation of actin - associated protein synaptopodin. Proc Natl Acad Sci U S A,2020, 117(21): 11648-11657.
【17 】Huang J, Pearson JA, Peng J, et al. Gut microbial metabolites alter IgA immunity in type 1 diabetes. JCI Insight, 2020, 5(10):e135718.
【18 】Xiao L, Van't Land B, Engen PA, et al. Human milk oligosaccharides protect against the development of autoimmune diabetes in NOD-mice. Sci Rep, 2018, 8(1):3829.
【19 】Xiu W, Chen Q, Wang Z, et al. Microbiota - derived short chain fatty acid promotion of amphiregulin expression by dendritic cells is regulated by GPR43 and Blimp - 1. Biochem Biophys Res Commun,2020, 533(3): 282-288.
【20】 Zaiss DMW, Gause WC, Osborne LC, et al. Emerging functions of amphiregulin in orchestrating immunity, inflammation, and tissue repair. Immunity, 2015, 42(2): 216-226 .
【21】 Nakano T, Uchiyama K, Ushiroda C, et al. Promotion of wound healing by acetate in murine colonic epithelial cell via c - Jun N - terminal kinase activation. J Gastroenterol Hepatol, 2020, 35(7):1171-1179 .
【22 】Arpaia N, Campbell C, Fan X, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T - cell generation. Nature, 2013, 504(7480):451-455 .
【23 】Sivaprakasam S, Ganapathy PK, Sikder MOF, et al. Deficiency of dietary fiber in Slc5a8 - null mice promotes bacterial dysbiosis and alters colonic epithelial transcriptome towards proinflammatory milieu. Can J Gastroenterol Hepatol, 2019, 2019: 2543082.
【24】 Singh N, Thangaraju M, Prasad PD, et al. Blockade of dendritic cell development by bacterial fermentation products butyrate and propionate through a transporter (Slc5a8) - dependent inhibition of histone deacetylases. J Biol Chem, 2010, 285(36): 27601-27608.
【25】 Smith PM, Howitt MR, Panikov N, et al. The microbial metabolites,short - chain fatty acids, regulate colonic Treg cell homeostasis.Science, 2013, 341(6145): 569-573.
【26 】Luu M, Visekruna A. Short - chain fatty acids: Bacterial messengers modulating the immunometabolism of T cells. Eur J Immunol,2019, 49(6): 842-848.
【27】 Chen B, Sun L, Zhang X. Integration of microbiome and epigenome to decipher the pathogenesis of autoimmune diseases. J Autoimmun, 2017, 83: 31-42.
【28】 Pernomian L, Duarte - Silva M, de Barros Cardoso CR. The Aryl hydrocarbon receptor (AHR) as a potential target for the control of intestinal inflammation: insights from an immune and bacteria sensor receptor. Clin Rev Allergy Immunol, 2020, 59(3): 382-390.29 Alexeev EE, Lanis JM, Kao DJ, et al. Microbiota - derived indolemetabolites promote human and murine intestinal homeostasis through regulation of interleukin - 10 receptor. Am J Pathol, 2018,188(5): 1183-1194.
【30 】Zegarra - Ruiz DF, El Beidaq A, Iñiguez AJ, et al. A diet - sensitive commensal lactobacillus strain mediates TLR7 - dependent systemicautoimmunity. Cell Host Microbe, 2019, 25(1):113-127.
【31 】Liu X, Hou Y, Peng J. Advances in immunopathogenesis of adult immune thrombocytopenia. Front Med, 2013, 7(4): 418-424.
【32】 Fang J, Lin L, Lin D, et al. The imbalance between regulatory memory B cells reveals possible pathogenesis involvement in pediatric immune thrombocytopenia. Hematology, 2019,24(1):473-479.
【33】 Wang SC, Yang KD, Lin CY, et al. Intravenous immunoglobulin therapy enhances suppressive regulatory T cells and decreases innate lymphoid cells in children with immune thrombocytopenia.Pediatr Blood Cancer, 2020, 67(2): e28075.
【34】 Lu Y, Cheng L, Li F, et al. The abnormal function of CD39 +regulatory T cells could be corrected by high - dose dexamethasone in patients with primary immune thrombocytopenia. Ann Hematol,2019, 98(8): 1845-1854.
【35】 Wu D, Liu Y, Pang N, et al. PD - 1/PD - L1 pathway activation restores the imbalance of Th1/Th2 and treg/Th17 cells subtypes in immune thrombocytopenic purpura patients. Medicine (Baltimore),2019, 98(43): e17608.
【36】 Arpaia N, Campbell C, Fan X, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T - cell generation. Nature, 2013, 504(7480): 451-455.
【37】 Zhao HY, Ma YH, Li DQ, et al. Low - dose chidamide restores immune tolerance in ITP in mice and humans. Blood, 2019,133(7):730-742.
【38 】Zhang X, Gu S, You L, et al. Gut microbiome and metabolome were altered and strongly associated with platelet count in adult patients with primary immune thrombocytopenia. Front Microbiol, 2020,11: 1550.
【39 】Liu C, Cheng L, Ji L, et al. Intestinal microbiota dysbiosis play a role in pathogenesis of patients with primary immune thrombocytopenia. Thromb Res, 2020, 190: 11-19.
#酒局守护神 #酉神1号 #酉神一号 #酉神壹号 #酒神1号 #酒神一号 #酒神壹号 #酉神1号解酒液 #酉神1号有机酸解酒液






