发布时间:2024-12-18 浏览:143次
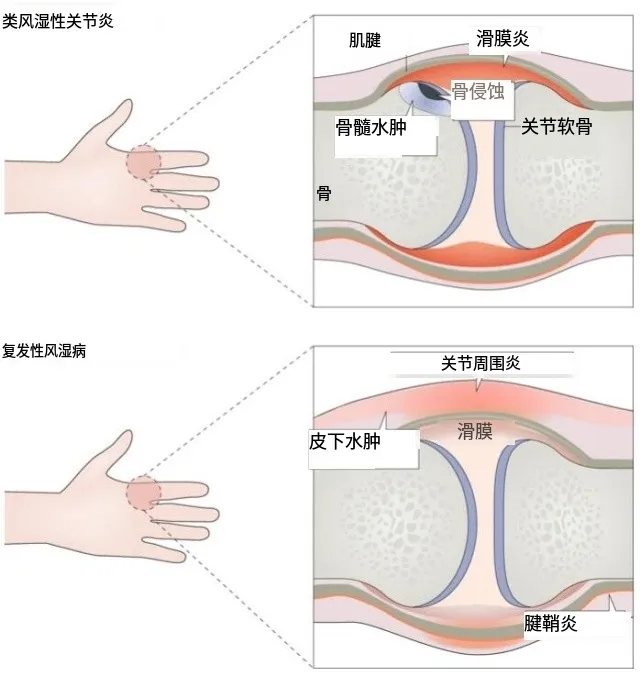
类风湿关节炎(Rheumatoid Arthritis,RA)是一种成因复杂、慢性难愈的免疫系统疾病,以骨关节炎症反应为主要症状表现,对患者的生活状态影响巨大并给家庭和社会带来沉重负担。
根据数据库和病例定义,RA在成年群体中患病率在0.5%~1%之间,每年每10万例新病例中有5~50例,多发于女性和老年群体 [1] ,由于涉及不止单一系统,其研究已不再局限于骨关节及免疫系统,肠道微生态也深入参与了该病的发生与发展。
宿主的免疫系统与肠道微生物之间构成了一种微妙的平衡状态,即宿主为微生物提供稳定且有利于其生存的生长环境,而肠道微生物在共生过程中为宿主承担一部分分解、消化功能,改变药物,环境毒物和重金属的代谢结果 [2] ,并提供代谢产物使之获得必要的营养素,短链脂肪酸 (Short chain fatty ac⁃ids,SCFAs)作为肠道微生物的主要代谢产物,能调节宿主细胞免疫代谢、使血清促炎因子减少,并且各种微生物之间形成种群之间的数量平衡以维护肠道黏膜屏障,减少感染风险。
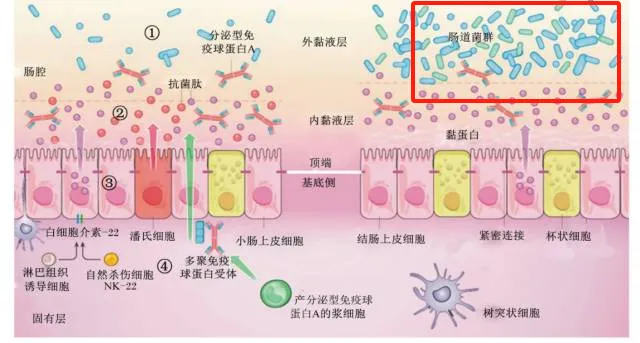
以下综述将讨论肠道微生态通过其产物短链脂肪酸对类风湿性关节炎形成的干预作用。
1 短链脂肪酸的来源及生理功能
1.1 短链脂肪酸的来源
微生物组这一概念最先由Joshua Lederberg提出[3] ,该观点把人与共生微生物看成一个共生的超级生物。微生物与人体的关系可分为共存、共生或致病3种状态。
另一种概念则认为肠道菌群是独立于消化系统的器官,足够长度的消化道为微生物提供了绝佳的生活场所。由于大肠内生长着为数众多的微生物群,多数与机体形成共生关系,所以这些微生物也在大肠中发挥着重要的次级发酵、分解和消化作用,蛋白质、肽、糖蛋白等难以被人体消化的物质进入肠道后多可由肠道微生物发酵、分解、代谢。包括SCFAs、气体和有机酸在内,都是由肠道微生物负责生产的,它们是代谢的产物 [4-5] 生产者包括大肠杆菌在内的结肠厌氧菌[6] 。
SCFAs是一类碳原子数小于5的脂肪酸,一般而言,乙酸盐、丙酸盐和丁酸盐含量最高 [7] 。机体肠道环境,如肠道运输速度、pH值、温度、神经内分泌以及肠道微生物种群的数量和比例都可以影响SCFAs的含量。与人类相同,使用高纤维膳食饲养可以在模型动物肠道提高SCFAs含量 [8] ,并观察其干预效应。
1.2 短链脂肪酸的基本功能
在机体内,SCFAs可以降低肠道pH值,稳定结肠环境,控制肠内微生物种群和数量以维护肠道黏膜屏障,使结肠免受炎症反应并降低有害菌的感染风险 [9] ,它们是结肠细胞的能量来源之一,也可以通过门静脉运输到外周循环以作用于肝脏和外周组织并参与介导宿主多种生物过程 [7] 。
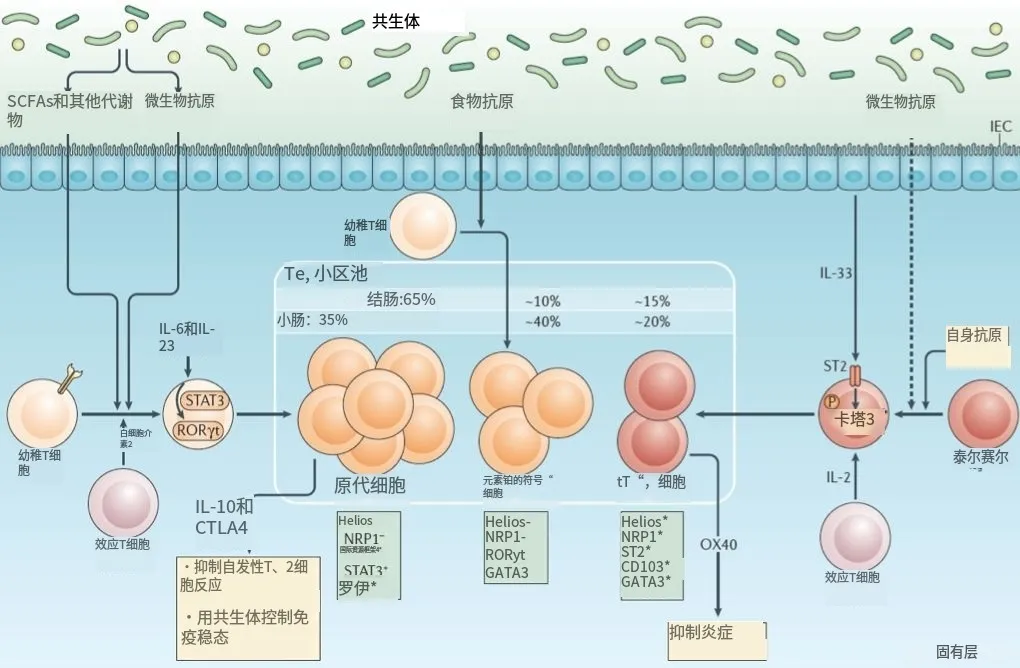
食物纤维降解而来的短链脂肪酸(short chain fatty acids,SCFAs)被认为是维持肠道pTreg细胞稳态的重要微生物代谢产物
同时,SCFAs尚可作为G蛋白的耦联构体,在GPR通路中发挥作用 [10] Yang等 [11] 研究认为,肠道菌群在肠道白细胞介素22 (IL-22) 的生产过程中至关重要,SC⁃FAs通过促进AhR和低氧诱导因子(HIF)1+表达来调节IL-22的产生,并可减少结肠炎症的发生。
另外SCFAs可激 活 Th1 细 胞 STAT3 和 哺 乳 动 物 雷 帕 霉 素 靶 蛋 白(mTOR),从而调节转录因子B淋巴细胞诱导的成熟蛋白1(Blimp-1)并调节白细胞介素(IL-10)的SCFAs诱导 [12] 。
2 短链脂肪酸与类风湿性关节炎
2.1 肠道微生态与类风湿性关节症状
越来越多的证据表明,肠道微生物及其代谢产物与各种自身免疫疾病的发病与炎症状态有着千丝万缕的联系。李培彩等 [13] 认为,免疫学和肠道菌群特征在最初的高峰期和关节炎复发之间是不同的,在关节炎的高峰期和复发期,胶原诱导型关节炎 (Collagen induced arthritis,CIA)组厚壁菌的相对丰度低于对照组,类杆菌的相对丰度高于对照组。
另外,已有证据显示普氏杆菌具有与RA患者中发现的两种人类自身抗原相似的表位 [14] 。尽管目前并不清楚肠道屏障损伤以及微生态紊乱是慢性疾病状态的结果还是致病因素 [15] ,微生物治疗和膳食结构调整对患者都具有正面的效果。
一项接受益生菌治疗的关于益生菌和安慰剂的随机对照研究显示了服用益生菌对RA的好处 [16] 特定的细菌可能参与更多的肠内膳食营养的代谢和分解反应,上调SCFAs的产生,下调血浆白细胞介素6 (IL-6) 和T细胞17的比例,以致关节炎症状也随之得到缓解 [17] 。
2.2 SCFAs有益于肠道屏障的维持
不只是炎症性肠病 [18] ,包括RA在内的其他自身免疫疾病也常伴随着肠道屏障功能障碍 [19] 。肠道表面在结构上必然暴露于各种抗原和微生物环境中,黏膜炎症可能导致耐受性降低或直接激活自身免疫 [20] ,肠上皮细胞和黏液层能够强烈影响免疫反应并塑造微生物组成 [21] ,因此肠上皮细胞的稳定决定了肠道屏障的状态,这是机体抵御微生物和抗原侵袭的重要物质结构,与肠道健康密切相关。
上皮屏障的通透性增加预示着肠道屏障的衰退,导致肠漏综合征[22] ,而肠道微生态失调与结肠氧化应激增加、肠道屏障功能障碍,炎症反应和全身自身免疫标志物有关[23] 。Tajik等 [24] 使用丁酸或肠道大麻素受体1激动剂纠正肠道屏障的同时也观察到了关节炎的缓解,研究认为丁酸盐治疗恢复了FITC-葡聚糖(FD4)的上皮屏障功能和胃肠道通透性并缓解关节炎症状,改善肠道屏障功能的治疗可以减轻关节炎症状,丁酸盐是微生态和肠道屏障平衡的重要介质。
2.3SCFAs是肠-关节轴的重要介导物质
RA的发病过程是极为复杂的,其症状也不止步于关节相关症状,肠道环境稳态失衡或许显示其系统性损害的某一方面。Zaiss等 [25] 提出,机体与肠道微生物形成并实现了“微生物—肠—关节轴”这一特殊的共生关系,表明肠道的健康状态和关节炎症可以相互影响。持续用药也使肠道微生物发生了变化,一些具有抗风湿作用的中草药还能杀灭细菌,进入人体后将直接影响到肠道微生态 [26] ,小檗碱降低了肠道菌群的多样性,以致产生丁酸盐的细菌种类上调,促进丁酰辅酶A、乙酸-辅酶A转移酶(BUT)的表达和活性后,改善CIA大鼠的病理状态 [27] 。
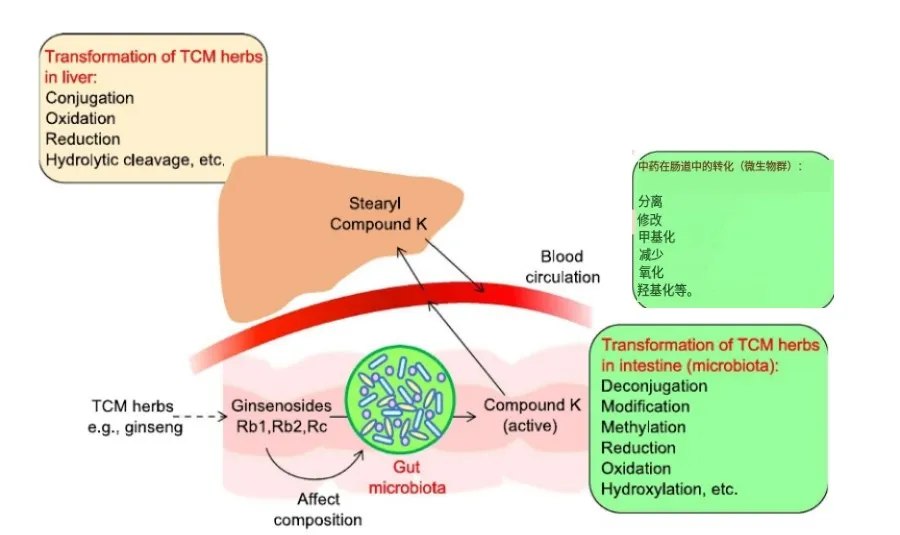
草药对肠道菌群的影响
中药对肠道菌群的干预影响力度较来氟米特、甲氨喋呤更大,肠道微生物可能会影响苯丙氨酸代谢 [26] ,并进一步改变丙酸的水平 [28] 在朝鲜白术(Nakai)干预后,小鼠关节肿胀程度得到了改善,并纠正了紊乱的肠道菌群和SCFAs,且具有剂量依赖性,使血浆中 TNF-α、IL-1、IL-1β、IL-2、IL-6、hs-CRP水平下降 [29] 。
2.4 SCFAs对免疫系统和炎症反应的干预
补充微生物衍生的SCFA丁酸盐可降低关节炎的严重程度,已在小鼠实验中得到了体现,Rosser等 [30] 发现RA患者及小鼠与健康对照组相比,微生物来源的SCFAs含量降低,研究还发现RA患者外周血B细胞亚群和IL-10B细胞频率与粪便中乙酸盐、丙酸盐和丁酸盐水平相关,补充丁酸盐可以缓解小鼠关节炎症状,但B细胞缺乏小鼠不能获益,表明了B细胞在丁酸盐介导关节炎抑制的独特地位。
这可能是由于通过AhR激活补充丁酸盐控制支持Breg功能的分子程序,同时抑制生发中心(GC)B细胞和浆细胞分化,最终减轻了关节炎症。Hui等 [31] 研究表明,丁酸盐调节介导了CD4+T细胞向Treg细胞的分化,其产生抗炎细胞因子IL-10,从而影响Th17细胞的功能,抑制了炎症细胞因子的表达,最终缓解了CIA小鼠的关节炎相关症状,除此之外,研究发现丁酸酯虽能选择性抑制IL-17A,但不能抑制IFN-γ的表达。
Bai等 [32] 发现丙酸盐通过促进体内外Treg细胞的扩增和IL-10的升高来改善胶原诱导的关节炎,摄入富含抗性淀粉的高纤维饮食可以使肠道短链脂肪酸(SCFA)乙酸,丙酸盐和异丁酸盐的血清水平增加。
2.5 短链脂肪酸对骨代谢的干预
RA的发生发展过程中,骨代谢的改变是其病理的一大特征 [33] 。破骨细胞被诱导、成骨细胞被抑制,原有的正常骨转化状态也被改变,使得RA患者身上产生了不同程度的骨关节病理变化,例如软骨损伤、骨侵蚀以及骨质疏松[34] 。
丁酸盐或其来源细菌可调节Treg细胞分化,促进实验动物的骨骼形成。针对这一系列现象,研究者们设计了实验以探究肠道SCFAs对骨破坏和骨形成的干预作用。Lucas[35] 等在CIA小鼠模型中研究了SCFA和高纤维饮食对炎症性骨质流失的作用,丙酸盐和丁酸盐改善了小鼠的关节肿胀并使其握力增加,骨骼中破骨细胞特异性基因表达显著下调,破骨细胞减少了19.55%,成骨细胞没有显著变化,抑制了骨质流失。
Hager等 [36] 研究认为,服用高纤维饮食4周后的人群,骨侵蚀标记减少、Th1/Th17比率显示RA相关结局有所好转。Yan等 [37] 认为通过干预肠道菌群可以优化骨骼的生长和健康状态,研究显示,肠道微生物群诱导上调了胰岛素样生长因子1(IGF-1),促进骨骼生长和重塑,而且微生物分解产生的SCFAs也具有相同效果,使用SCFAs治疗可以拮抗因药物导致的IGF-1下调。
报道显示,口服SCFAs抑制了全身性自身免疫疾病,但SCFAs仍有可能增加炎症反应,在抗体诱导型的RA中尤为如此。丙酸酯或丁酸酯的治疗引起TNF-α表达的显著上调。丙酸和丁酸处理的小鼠中诱导型一氧化氮合酶(iNOS)的表达有增加的趋势,可产生更高水平的NO并促进破骨细胞的过度生成,导致关节损伤和骨量减少 [38] 。
3 总结
“肠—关节轴”概念的提出使科研人员和临床医师更加重视肠道微生物及其代谢产物在类风湿性关节炎中的干预作用。
各种相关研究共同说明了短链脂肪酸在肠道稳态和肠道屏障的维护方面有着极重要的作用,同时在免疫、炎症反应以及骨代谢方面也极具科研和临床前景,这将为类风湿性关节炎患者带来收益。
短链脂肪酸对类风湿关节炎的影响来源于特定肠道菌群对膳食纤维的发酵分解,但目前的研究并不足以阐明肠道微生态及其产物短链脂肪酸对类风湿性关节炎产生正面效应的机制和源头。
因此,深入研究肠道菌群、膳食纤维及短链脂肪酸各单体将有助于认识本病发生发展过程,并为本病的预防与治疗带来临床和实验证据的支撑。
#参考文献#
[1] SCOTT D L, WOLFE F, HUIZINGA T W. Rheumatoid arthri⁃tis [J]. Lancet, 2010, 376(9746): 1094-1108.
[2] COLLINS S L, PATTERSON A D. The gut microbiome: an or⁃chestrator of xenobiotic metabolism[J]. Acta Pharm Sin B,2020, 10(1): 19-32.
[3] LEDERBERG J. The microbe's contribution to biology-50 years after [J]. Int Microbiol, 2006, 9(3): 155-156.
[4] MARTIN-GALLAUSIAUX C, MARINELLI L, BLOTTIERE HM, et al. SCFA: mechanisms and functional importance in the gut [J]. Proc Nutr Soc, 2021, 80(1): 37-49.
[5] MAKKI K, DEEHAN E C, WALTER J, et al. The Impact of Di⁃etary Fiber on Gut Microbiota in Host Health and Disease[J].Cell Host Microbe, 2018, 23(6): 705-715.
[6] 付阳. 从健康人体肠道微生物群中分离的大肠杆菌产生的短链脂肪酸具有抗癌和抗炎作用[J]. 广东饲料,2021,30(5):51.
[7] KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, etal. From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites[J]. Cell, 2016, 165(6):1332-1345.
[8] MORRISON D J, PRESTON T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabo⁃lism[J]. Gut Microbes, 2016, 7(3): 189-200.
[9] DI TOMMASO N, GASBARRINI A, PONZIANI F R. Intestinal Barrier in Human Health and Disease[J]. Int J Environ Res Public Health, 2021, 18(23).
[10] LI M, VAN ESCH B, WAGENAAR G, et al. Pro- and anti-in⁃flammatory effects of short chain fatty acids on immune and endothelial cells [J]. Eur J Pharmacol, 2018, 831: 52-59.
[11] YANG W, YU T, HUANG X, et al. Intestinal microbiota-de⁃rived short-chain fatty acids regulation of immune cell IL-22 production and gut immunity[J]. Nat Commun, 2020, 11(1):4457.
[12] SUN M, WU W, CHEN L, et al. Microbiota-derived short-chain fatty acids promote Th1 cell IL-10 production to maintain intestinal homeostasis[J]. Nat Commun, 2018, 9(1): 3555.
[13] 李培彩,唐艳萍. 胃食管反流病与消化道微生态关系的研究进展[J]. 国际消化病杂志,2020,40(3):153-156.
[14] PIANTA A, ARVIKAR S L, STRLE K, et al. Two rheumatoid arthritis-specific autoantigens correlate microbial immunity with autoimmune responses in joints[J]. J Clin Invest, 2017,127(8): 2946-2956.
[15] JULIO-PIEPER M, BRAVO J A. Intestinal Barrier and Behav⁃ior [J]. Int Rev Neurobiol, 2016, 131: 127-141.
[16] ZAMANI B, GOLKAR H R, FARSHBAF S, et al. Clinical and metabolic response to probiotic supplementation in pa⁃tients with rheumatoid arthritis: a randomized, double-blind,placebo-controlled trial[J]. Int J Rheum Dis, 2016, 19(9):
869-879.
[17] FAN Z, ROSS R P, STANTON C, et al. Lactobacillus casei CCFM1074 Alleviates Collagen-Induced Arthritis in Rats via Balancing Treg/Th17 and Modulating the Metabolites and Gut Microbiota[J]. Front Immunol, 2021, 12: 680073.
[18] PARADA V D, DE LA FUENTE M K, LANDSKRON G, etal. Corrigendum: Short Chain Fatty Acids (SCFAs)-Mediated Gut Epithelial and Immune Regulation and Its Relevance for Inflammatory Bowel Diseases[J]. Front Immunol, 2019, 10:1486.
[19] GRO SCHWITZ K R, HOGAN S P. Intestinal barrier fonctin:Molecular regulotion and disease pathogenesis[J]. Journal of Allergy and Clinical Immunology, 2009.
[20] BRANDL C, BUCCI L, SCHETT G, et al. Crossing the barri⁃ers: Revisiting the gut feeling in rheumatoid arthritis[J]. EurJ Immunol, 2021, 51(4): 798-810.
[21] ANTONINI M, LO C M, SORINI C, et al. How the Interplay Between the Commensal Microbiota, Gut Barrier Integrity, and Mucosal Immunity Regulates Brain Autoimmunity[J]. Front Immunol, 2019, 10: 1937.
[22] KINASHI Y, HASE K. Partners in Leaky Gut Syndrome: Intes⁃tinal Dysbiosis and Autoimmunity[J]. Front Immunol, 2021,12: 673708.
[23] WANG H, WANG G, BANERJEE N, et al. Aberrant Gut Mi⁃crobiome Contributes to Intestinal Oxidative Stress, Barrier Dysfunction, Inflammation and Systemic Autoimmune Respons⁃es in MRL/lpr Mice[J]. Front Immunol, 2021, 12: 651191.
[24] TAJIK N, FRECH M, SCHULZ O, et al. Targeting zonulin and intestinal epithelial barrier function to prevent onset of ar⁃thritis [J]. Nat Commun, 2020, 11(1): 1995.
[25] ZAISS M M, JOYCE W H, MAURO D, et al. The gut-joint ax⁃is in rheumatoid arthritis[J]. Nat Rev Rheumatol, 2021, 17(4): 224-237.
#酒局守护神 #酉神1号 #酉神一号 #酉神壹号 #酒神1号 #酒神一号 #酒神壹号 #酉神1号解酒液 #酉神1号有机酸解酒液






