发布时间:2024-12-17 浏览:145次
(本文部分来源转载自公众号:迈维代谢)
短链脂肪酸(short-chainfatty acids,SCFAs),也称挥发性脂肪酸(Volatilefattyacids,VFAs),通常把碳原子数为1-6的有机脂肪酸称为短链脂肪酸。主要包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸。
SCFAs是肠道菌群的代谢产物,人体约90%SCFAs是由厌氧微生物发酵难消化的碳水化合物而产生,余下部分则是由饮食摄入和蛋白质等代谢产生,正常人体肠道每日可产生约50~100mmol SCFAs,在结肠中乙酸、丙酸、丁酸占SCFAs总量的95%左右,三者比例大致为3:1:1。
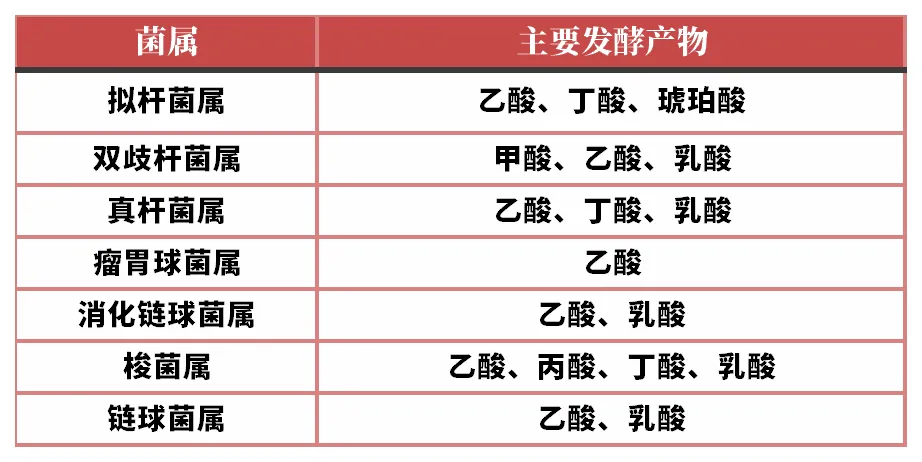
SCFAs的主要产生部位是结肠,而它的种类和数量则主要取决于肠道内菌群组成、消化时间(在肠道运转的时间)、宿主-微生物代谢通量以及宿主食物中的纤维含量。产短链脂肪酸的菌群主要有拟杆菌属、双歧杆菌属、真杆菌属、瘤胃球菌属、消化链球菌属、梭菌属、链球菌属。
肠道菌群产生的SCFAs可直接调节宿主健康,SCFAs可通过能量调节、肠粘膜屏障、免疫调节、诱导肿瘤细胞分化及凋亡等方式行使功能,当机体SCFAs的含量失去平衡,就会表现出各种疾病。
1 神经性疾病
SCFAs可以调节小胶质细胞的成熟及功能,通过脑肠-轴影响神经系统疾病,如帕金森、阿尔茨海默病等,SCFAs可缓解焦虑。
短链脂肪酸(SCFAs)是由结肠中的膳食纤维经过微生物发酵产生的,它们可能通过调节微生物-肠-脑通信来发挥作用。
帕金森病(Parkinson's disease,PD)是常见的慢性神经退行性疾病之一,出现典型的运动功能缺失前,表现为非运动系统症状,如异常的胃肠运动和便秘[1-2]。某些肠道微生物的缺失可能伴随着短链脂肪酸(short⁃chain fattyacids,SCFAs)显著减少,结肠上皮细胞受损,同时影响宿主的生理状态,从而可能导致内毒素和神经毒素产生增加[3-4]。
帕金森病进展中,运动波动和非运动症状严重程度与小肠细菌过度生长具有相关性。治疗小肠细菌过度生长可以改善PD患者的运动波动症状[5]。这些证据表明肠道微生物⁃肠⁃脑轴的相互作用可能参与了PD病理过程,提示 PD的病理过程可能是由肠道扩展到脑[6-7]。
阿尔兹海默症(Alzheimer’s disease,AD)是一种复杂的进行性发展的神经系统疾病,主要症状包括淀粉样蛋白沉积、神经纤维缠结、记忆认知障碍、神经炎症一系列神经退行性病变[8-9]。近十年来,越来越多的研究表明,肠道菌群及其代谢产物通过脑肠轴之间的双向作用,在调节中枢神经系统疾病的脑部功能中发挥重要作用[10-11]。多项临床研究证实轻度认知障碍及AD者肠道菌群结构及组成发生改变[12-13]。此外,有研究阐述了菌群的代谢物,尤其是脂多糖、短链脂肪酸(short⁃chain fatty acids,SCFAs)、胆汁酸和氨基酸等,能够缓解机体脑神经失调[14-15]。
2 免疫类疾病
丁酸可调节先天性和适应性免疫细胞的产生,流通和功能。
先天性免疫是机体对外界病原体的初始防御机制,包括巨噬细胞、自然杀伤细胞和炎症细胞等。研究发现,丁酸可以促进巨噬细胞的产生和活化,增强其吞噬病原体和产生杀菌物质的能力。
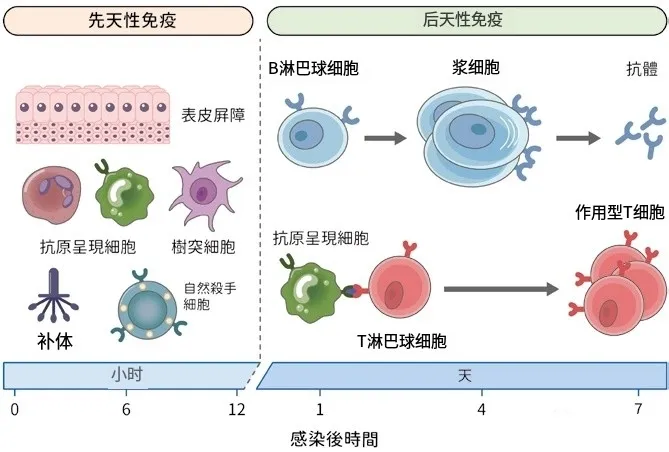
适应性免疫是机体对特定病原体的免疫应答,包括T细胞和B细胞等。研究发现,丁酸可以促进T细胞的产生和活化,增强其对病原体的识别和攻击能力。此外,丁酸还可以促进B细胞的产生和免疫球蛋白的产生,增强机体的抗体水平。
此外,丁酸还可以调节免疫细胞的流通和功能。研究发现,丁酸可以增加免疫细胞在淋巴结和脾脏等淋巴组织中的积聚,提高免疫细胞的浓度和活性。同时,丁酸还可以增强免疫细胞的迁移能力和黏附能力,使其更容易与病原体发生接触和相互作用。
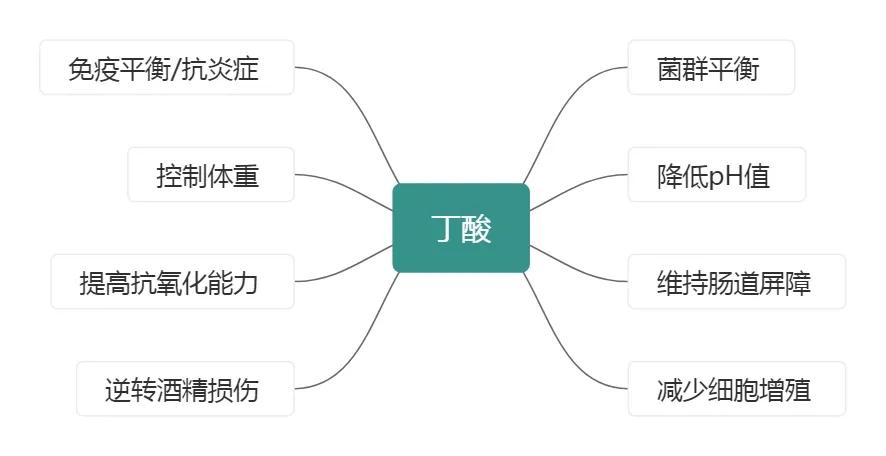
丁酸通过调节先天性和适应性免疫细胞的产生、流通和功能,增强机体的免疫能力,提高对外界病原体的防御能力。这对于预防和治疗免疫相关疾病具有重要意义。
3 肿瘤疾病
丁酸能抑制某些肿瘤细胞增殖,并诱导肿瘤细胞分化和凋亡,可应用到结肠肿瘤的治疗上。
研究表明,丁酸可以通过多种机制抑制肿瘤细胞的增殖。首先,丁酸可以阻断肿瘤细胞的能量供应途径,抑制其代谢活性。其次,丁酸可以干扰肿瘤细胞的DNA合成和修复,导致细胞周期停滞和DNA损伤。此外,丁酸还可以调节多种信号通路,如PI3K/Akt和MAPK等,影响肿瘤细胞的增殖和存活。
此外,丁酸还可以诱导肿瘤细胞的分化和凋亡。研究发现,丁酸可以促使肿瘤细胞向成熟细胞分化,从而抑制其增殖能力。同时,丁酸还可以通过激活蛋白激酶C(PKC)和调节Bcl-2家族蛋白等机制,诱导肿瘤细胞进行凋亡。
然而,需要注意的是,丁酸在肿瘤治疗中的应用仍处于研究阶段,尚未在临床上得到广泛应用。目前的研究主要集中在体外和动物实验中,还需要进一步的研究来确定其在临床治疗中的安全性和有效性。此外,丁酸的用量、给药途径和联合治疗等方面也需要进一步研究和优化。
4 心脑血管
丙酸可减轻血管炎症和动脉粥样硬化。
动脉粥样硬化是一种慢性炎症性血管疾病,其特征是血管内脂质沉积和炎症反应的形成。丙酸可以通过多种途径对血管炎症和动脉粥样硬化进行干预。
首先,丙酸可以调节炎症反应。研究发现,丙酸可以抑制炎症介质的产生和释放,如白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)等。这些炎症介质在动脉粥样硬化的发展过程中发挥重要作用,丙酸的抑制作用可以减少炎症反应、改善血管内环境。
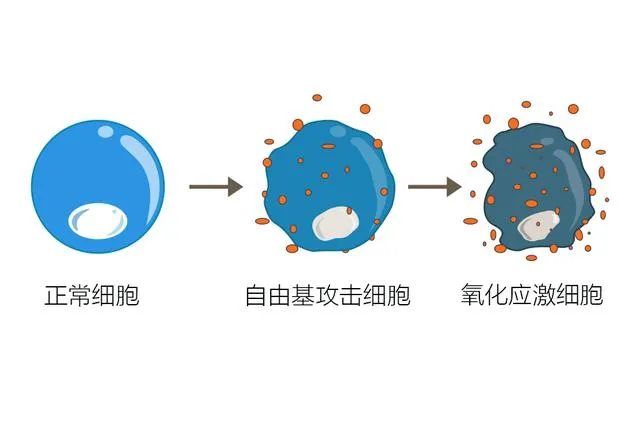
其次,丙酸还可以影响氧化应激反应。氧化应激反应是动脉粥样硬化发展中的另一个重要因素,可以导致血管内脂质氧化和炎症反应的加剧。研究发现,丙酸可以通过抑制氧化应激反应,降低活性氧的产生和氧化损伤,从而减轻血管炎症和动脉粥样硬化的程度。
此外,丙酸还可以调节脂质代谢。动脉粥样硬化的发展与血液中脂质的异常代谢有关。研究发现,丙酸可以降低血液中的甘油三酯和胆固醇水平,减少脂质在血管壁内的沉积,从而减轻动脉粥样硬化的进展。
需要指出的是,尽管丙酸的抗炎和抗氧化作用在实验室研究中已经得到了证实,但在临床治疗中的应用仍需更多的研究和验证。此外,丙酸的用量、给药途径和联合治疗等方面还需要进一步探索和优化。
5 胃肠道疾病
SCFAs可减少肠道电解质相关的腹泻,丁酸治疗先天性氯化物腹泻,适量SCFAs可抑制大肠埃希菌属、志贺菌属等致病菌或条件致病菌生长,保护肠道,高浓度的SCFAs损害肠黏膜,可能参与新生儿坏死性小肠结肠炎的发生。
炎症性肠病
(包括克罗恩病和溃疡性结肠炎):研究发现,炎症性肠病患者的肠道中SCFAs的产生和浓度通常较低。SCFAs可以抑制炎症反应、增强肠道黏膜屏障功能,从而对炎症性肠病的病理过程具有保护作用。
肠易激综合征(IBS)
研究发现,IBS患者的肠道中SCFAs的产生和浓度可能异常。SCFAs可以调节肠道蠕动、改善肠道黏膜屏障功能,从而对IBS的症状缓解有一定的作用。

肠道感染
SCFAs可以通过调节肠道菌群、增强肠道黏膜屏障功能和抑制病原菌的生长,起到抗菌和抗病毒的作用。因此,SCFAs可能对肠道感染的预防和治疗具有一定的潜力。
6 代谢性疾病

SCFAs可以促进胰岛素分泌,降低脂肪堆积,可治疗肥胖以及Ⅱ型糖尿病。
研究发现,肥胖者的肠道中SCFAs的产生和浓度较低。SCFAs可以调节能量代谢、抑制脂肪细胞增殖和促进能量消耗,从而可能对肥胖和代谢性疾病的发生和发展具有影响。
促进胰岛素分泌:研究发现,SCFAs可以刺激胰岛细胞分泌胰岛素。具体而言,丙酸和丁酸被认为是胰岛细胞的重要能量来源,能够增加细胞内ATP水平,从而促进胰岛素的释放。此外,SCFAs还可以通过激活G蛋白偶联受体(GPR)43和GPR41等受体,调节胰岛素的分泌。
降低脂肪堆积:SCFAs可以通过多种机制降低脂肪堆积。首先,SCFAs可以促进脂肪细胞分化和脂肪酸氧化,从而增加脂肪酸的消耗。其次,SCFAs可以抑制脂肪细胞的增殖和分化,减少脂肪细胞的数量和体积。此外,SCFAs还可以调节脂肪细胞的激素敏感性,如增强胰岛素的作用和抑制脂肪生成的相关基因表达。
肥胖和Ⅱ型糖尿病通常伴随着胰岛素抵抗和脂肪堆积。因此,SCFAs的胰岛素促泌和脂肪降解作用使其具备潜在的治疗肥胖和Ⅱ型糖尿病的能力。然而,需要指出的是,目前对于SCFAs在肥胖和Ⅱ型糖尿病治疗中的应用仍处于研究阶段,尚需进一步的研究和临床实验验证其安全性和有效性。
#参考文献#
[1]FasanoA,VisanjiNP,Liu LW, etal.Gastrointestinaldysfunc-tioninparkinson'sdisease[j].LancetNeurol,2015,14(6):625-639 .
[2]PfeifferRF.GastrointestinaldysfunctioninParkinson'sdisease [J].ParkinsonismRelatDisord,2011,17(1):10-15.
[3] ErnyD,Hraběde Angeli sAL,JaitinD,etal. Hostmicrobiotaconstantlycontrolmaturationandfunctionofmicrogliain the CNS [J]NatNeurosci,2015,18(7)965-977.
[4] LiW, WuX,HuX,etal. structuralchangesofgutmicrobiotainparkinson'sdisease andits correlationwi thclinicalfeatures[J].Sci ChinaLifesci,2017,60(11):1223-1233.
[5]FasanoA,緔年邮 ove F,GabrielliM,et al.The role ofsmallintestinalbacterialovergrowthinparkinson'sdisease[J].MovDisord,2013,28(9):1241-1249 .
[6] Mayer EA,Tillisch K,GuptaA. Gut/brainaxis and themicrobi-ota[J].」ClinInvest,2015,125(3):926-938.
[7] Mulak A, Bonaz B. Brain-gut-microbiotaaxisinParkinson'sdis-ease[J]World」Gastroenterol,2015,21(37):10609-10620.[8]SCHELTENS P,BLENNOWK,BRETELERMMB,etal.A1zhei-mer's disease[J]. The Lancet,2016,388(10043):505-517.
[9] CHOISH,BYLYKBASHIE,CHATILA Z K,etal.Combinedadultneurogenesisand BDNFmimicexerciseeffectsoncognitioninanAlzheimer's mousemodel[J].science,2018,361(6406).DOI:10.1126/science. aan8821.[10]CRYAN JF.O'RIORDAN KSANDHU K,et al.g u tThemicrobi-omeinneurologicaldisorders[J].
TheLancetNeurology,2020,19(2):179-194.
[11] CRYAN JF,O'RIORDAN KJ,COWANCSM,etal.Themicrobiota-gut-brainaxis[J].PhysiologicalReviews,2019,99(4):1877-2013ZHUANGZQ,SHENLL,L
[12]IWW,et al.Gut microbio taisalteredinpatients with Alzheimer's disease[J].JournalofAlzheimer's Dis-ease,2018,63(4):1337-1346.
[13] VOGT NM,KERBYRL,DILL-MCFARLAND KA,et al. Gutmi-crobiomealterations inAlzheimer'sdisease[J].ScientificReports,2017,7:13537.
[14] KOH A,DE VADDER F,KOVATCHEVA-DATCHARYP,etal.Fromdietary fiber to host physiology:short-chain fattyacidsas key bacterialmetabolites].Ce11,2016,165(6):1332-134 5.ZHAN XH,STAMOVA B,J
[15]INLW,etal.Gram-negative bacterial molecules
associate with Alzheimer disease pathology[Jl.
Neuro1o-gy, 2016,87(22):23242 332.
#酒局守护神 #酉神1号 #酉神一号 #酉神壹号 #酒神1号 #酒神一号 #酒神壹号 #酉神1号解酒液 #酉神1号有机酸解酒液






